Banyu

Banyu (Krama: toya, Kawi: way, wé) iku senyawa kang wigati kanggo kabèh wangun kauripan kang dikawruhi nganti tekan saiki ing bumi,[1][2][3] nanging ora ing planit liya.[4] Banyu disimbolaké kanthi H2O.[5] Cacahé banyu kang nutupi bumi ngancik 71%. Ana 1,4 triliun kilomèter kubik (330 juta mil³) ing bumi.[6]
Banyu bisa awujud gas (uwap banyu), cuwèr (banyu) lan padhet (ès).[7] Banyu iku siji-sijiné dat kang kanthi alami ana ing lumahing bumi sajeroning katelu wujud mau.[8] Banyu sapérangan gedhé ana ing sagara (banyu asin) lan ing lapisan-lapisan ès (ing kutub lan pucuk-pucuk gunung), nanging uga bisa ana minangka méga, udan, kali, lumahing banyu tawa, tlaga, uwap banyu, lan sagara ès. Banyu sajeroning obyèk-obyèk mau obah miturut sawijiné pangitiran banyu, ya iku: liwat panguwapan, udan, lan ilènan banyu ing sadhuwuré lumahing lemah (ilèn, kalebu tuk, kali, muwara) tinuju sagara.
Banyu resik wigati kanggo kauripan manungsa. Sembrana anggoné nangani banyu, bisa ndadèkaké golèk banyu dadi angèl, monopolisasi, sarta privatisasi lan malah njalari crah.[9]
Indonésia wis duwé undhang-undhang kang ngatur sumber daya banyu wiwit taun 2004, ya iku Undhang Undhang nomer 7 taun 2004 ngenani Sumber Daya Banyu.
Saliyané ing bumi, sapérangan gedhé banyu uga diprakirakaké ana ing kutub lor lan kidul planit Mars, sarta ing mbulan Europa lan Enceladus.
Sifat-sipat kimia lan fisika
[besut | besut sumber]| Banyu | |
|---|---|
| |
| Informasi lan sipat-sipat | |
| Jeneng sistematis | banyu |
| Jeneng alternatif | aqua, dihidrogen monoksida, Hidrogen hidroksida |
| Rumus molekul | H2O |
| Massa molar | 18.0153 g/mol |
| Densitas lan fase | 0.998 g/cm³ (cuwèran ing suhu 20 °C) 0.92 g/cm³ (padhetan) |
| Titik lebur | 0 °C (273.15 K) (32 °F) |
| Titik didih | 100 °C (373.15 K) (212 °F) |
| Kalor jinis | 4184 J/(kg·K) (cuwèran ing suhu 20 °C) |
| Kaca data tambahan | |
| Disclaimer and references | |
- Artikel utama: Banyu (molekul)
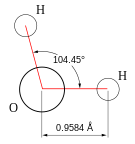
Banyu iku substansi kimia kanthi rumus kimia H2O: siji molekul banyu kasusun saka rong atom hidrogen kang kaiket kanthi kovalen marang siji atom oksigèn. Banyu asifat ora duwé warna, ora ana rasané lan ora mambu ing kaanan standhar, ya iku ing tekanan 100 kPa (1 bar) lan suhu 273,15 K (0 °C). Dat kimia iki wujud sawijiné pelarut kang wigati, kang duwé kemampuan kanggo nglarutaké akèh dat kimia liyané, kaya ta garam-garam, gula, asem, sapérangan jinis gas lan akèh manéka molekul organik.
Kaanan banyu kang wanguné cuwèr wujud sawijiné kaanan kang ora umum sajeroning kaanan normal, luwih-luwih manèh kanthi nggatèkaké gegandhèngan antarané hidrida-hidrida liya kang mèmper sajeroning kolom oksigèn ing tabèl periodik, kang ngisarataké yèn banyu kuduné awangun gas, kaya déné hidrogen sulfida. Kanthi nggatèkaké tabèl periodik, katon yèn unsur-unsur kang ngupengi oksigèn ya iku nitrogen, flor, lan fosfor, sulfur lan klor. Kabèh èlemèn-èlemèn iki yèn silih iketan karo hidrogen bakal ngasilaké gas ing suhu lan tekanan normal. Alesan witékna ngapa hidrogen silih iketan karo oksigèn minangka fasa mawa kaanan cuwèr, ya iku amarga oksigèn luwih asifat èlèktronégatif tinimbang èlemèn-èlemèn liya mau (kajaba flor). Tarikan atom oksigèn marang èlèktron-èlèktron iketan adoh luwih kuwat tinimbang kang dilakokaké déning atom hidrogen, ninggal gunggung momotan positif ing keloro atom hidrogen, lan gunggung momotan négatif ing atom oksigèn. Anané momotan ing saben atom mau agawé molekul banyu duwé sapérangan momen dipol. Gaya silih tarik listrik antar molekul-molekul banyu akibat anané dipol iki agawé saben molekul silih cerak, njalari angèl kanggo dipisahaké lan kang akiré ngunggahaké titik didih banyu. Gaya silih tarik iki ingaran minangka ikatan hidrogen.
Banyu asring ingaran minangka pelarut universal amarga banyu nglarutaké akèh dat kimia. Banyu ana sajeroning kasetimbangan dhinamis antarané fase cuwèr lan padhet ing sangisoré tekanan lan suhu standhar. Sajeroning wangun ion, banyu bisa didhèskripsikaké minangka sawijiné ion hidrogen (H+) kang silih asosiasi (silih iketan) karo sawijiné ion hidroksida (OH-).

Èlèktrolisis banyu
[besut | besut sumber]- Artikel utama: Èlèktrolisis banyu
Molekul banyu bisa diurai dadi unsur-unsur asalé kanthi diilèni arus listrik. Prosès iki ingaran èlèktrolisis banyu. Ing katoda, loro molekul banyu ngalami réaksi kanthi nangkep loro èlèktron, karéduksi dadi gas H2 lan ion hidrokida (OH-). Sauntara iku ing anoda, loro molekul banyu liya kaurai dadi gas oksigèn (O2), nguwalaké 4 ion H+ sarta ngilèkaké èlèktron menyang katoda. Ion H+ lan OH- ngalami nétralisasi saéngga kawangun manèh sapérangan molekul banyu. Réaksi sakabèhé kang setara karo èlèktrolisis banyu bisa ditulisaké kaya mangkéné.
Gas hidrogen lan oksigèn kang diasilaké saka réaksi iki minangka gelembung ing èlèktroda lan bisa diklumpukaké. Prinsip iki banjur dimupangataké kanggo ngasilaké hidrogen lan hidrogen peroksida (H2O2) kang bisa digunakaké minangka bahan bakar kendharaan hidrogen.[10][11][12]
Kalarutan (solvasi)
[besut | besut sumber]Banyu iku pelarut kang kuwat, nglarutaké akèh jinis dat kimia. Dat-dat kang campur lan larut kanthi becik sajeroning banyu (upamané garam-garam) ingaran minangka dat-dat "hidrofilik" (panyeneng banyu), lan dat-dat kang ora gampang kacampur karo banyu (upamané lemak lan lenga), ingaran minangka dat-dat "hidrofobik" (wedi-banyu). Kalarutan sawijiné dat jorning banyu ditemtokaké déning bisa orané dat mau nandhingi kakuwatan gaya silih tarik listrik (gaya intermolekul dipol-dipol) antarané molekul-molekul banyu. Yèn sawijining dat ora bisa nandhingi gaya silih tarik antar molekul banyu, molekul-molekul dat mau ora larut lan bakal ngendhep sajeroning banyu.

Kohèsi lan adhèsi
[besut | besut sumber]Banyu nèmpèl marang pepadhané (kohesi) amarga banyu asifat polar. Banyu duwé sapérangan momotan parsial négatif (σ-) cerak atom oksigèn akibat pasangan èlèktron kang (mèh) ora digunakaké bebarengan, lan sapérangan momotan parsial positif (σ+) cerak atom oksigèn. Sajeroning banyu babagan iki dumadi amarga atom oksigèn asipat luwih èlèktronégatif dibandhingaké atom hidrogen—kang tegesé, dhèwèké (atom oksigèn) duwé luwih "kakuwatan tarik" marang èlèktron-èlèktron kang diduwèni bebarengan sajeroning molekul, narik èlèktron-èlèktron luwih cerak menyang arahé (uga ateges narik momotan négatif èlèktron-èlèktron mau) lan agawé laladan ing saubengé atom oksigèn mawa momotan luwih négatif ketimbang laladan-laladan ing saubengé kaloro atom hidrogen.
Banyu uga nduwèwi sipat adhési kang dhuwur disebabaké déning sipat alami angka polar-ané.
Tegangan lumah
[besut | besut sumber]
Banyu duwé tegangan lumah kang gedhé kang disebabaké déning kuwaté sipat kohèsi antar molekul-molekul banyu. Iki bisa diamati nalika sapérangan cilik banyu dipapanaké sajeroning sawijiné lumahan kang ora bisa ditelesi utawa kalarutaké (non-soluble); banyu mau bakal ngumpul minangka sawijiné tètèsan. Ing ndhuwur sawijiné lumahan gelas kang resik banget utawa mawa lumahan alus banget, banyu bisa minangka sawijiné lapisan tipis (thin filem) amarga gaya tarik molekular antarané gelas lan molekul banyu (gaya adhèsi) luwih kuwat tinimbang gaya kohèsi antar molekul air.
Sajeroning sèl-sèl biologi lan organèl-organèl, banyu silih dumuk karo mèmbran lan lumahan protéin kang asifat hidrofilik; ya iku, lumahan-lumahan kang duwé daya tarik kuwat marang banyu. Irvin Langmuir ngamati sawijining gaya tolak kang kuwat antarné lumahan-lumahan hidrofilik. Kanggo nglakokaké dhéhidrasi sawijiné lumahan hidrofilik — sajeroning teges ngeculaké lapisan kang kaiket kanthi kuwat saka hidrasi banyu — perlu dilakokaké usaha temenanan nglawan gaya-gaya iki, kang diarani gaya-gaya hidrasi. Gaya-gaya mau gedhé banget pangajiné nanging ngluruh kanthi rikat sajeroning rentang nanomèter utawa luwih cilik. Wigatiné gaya-gaya iki sajeroning biologi wis disinaoni kanthi èkstènsif déning V. Adrian Parsegian saka National Institute of Health.[13] Gaya-gaya iki wigati mligi nalika sèl-sèl kadhéhidrasi silih dumuk langsung karo ruwang njaba kang garing utawa pangadheman ing njaba sèl (extracellular freezing).
Banyu sajeroning kauripan
[besut | besut sumber]
Saka pandelengan biologi, banyu duwé sipat-sipat kang wigati kanggo anané kauripan. Banyu bisa mijilaké réaksi kang bisa gawé senyawa organik ngakokaké réplikasi. Kabèh mahluk urip kang dikawruhi duwé gegantungan marang banyu. Banyu wujud dat pelarut kang wigati kanggo mahluk urip lan wujud pérangan wigati sajeroning prosès metabolisme. Banyu uga dibutuhaké sajeroning fotosintesis lan respirasi. Fotosintesis migunakaké cahya srengéngé kanggo misahaké atom hidrogen karo oksigèn. Hidrogen bakal kanggo minangka glukosa lan oksigèn bakal diculaké menyang udara.
Makluk banyu
[besut | besut sumber]- Artikel utama: Hidrobiologi
Lumahing banyu ing bumi dikebaki déning manéka jinis kauripan. Kabèh mahluk urip pisanan ing bumi iki asalé saka lumahing banyu. Mèh kabèh iwak urip ing njero banyu, saliyané iku, mamalia kaya ta lumba-lumba lan iwak paus uga urip ing njero banyu. Kéwan-kéwan kaya ta amfibi ngentèkaké sapérangan uripé ing njero banyu. Malah, sapérangan reptil kaya ta ula lan baya urip ing lumahing banyu cethèk lan sagara. Tetuwuhan sagara kaya ta alga lan suket laut dadi sumber panganan ékosistem lumahing banyu. Ing samodra, plankton dadi sumber pangan utama para iwak.
Banyu lan manungsa
[besut | besut sumber]Peradaban manungsa lestari nurut sumber banyu. Mesopotamia kang diarani awal peradaban ana ing antarané kali Tigris lan Euphrates. Peradaban Mesir Kuna gumantung ing kali Nil. Punjer-punjer manungsa kang gedhé kaya ta Rotterdam, London, Montreal, Paris, New York City, Shanghai, Tokyo, Chicago, lan Hong Kong olèh kajayané sapérangan amarga gampangé aksès liwat lumahing-limahing banyu.
Banyu kanggo ngombé
[besut | besut sumber]- Artikel utama: Banyu ombèn
Awak manungsa kapérang saka 55% nganti 78% banyu, gumantung saka ukuran awak.[14] Supaya bisa fungsi kanthi becik, awaké manungsa mbutuhaké antarané siji nganti pitung liter banyu saben dina kanggo ngèndhani dehidrasi; gunggung pesthiné gumantung marang tingkat aktivitas, suhu, kalembaban, lan sapérangan faktor liyané. Saliyané saka banyu ombèn-ombèn, manungsa éntuk cuwèran saka panganan lan ombénan liya. Sapérangan gedhé wong percaya yèn manungsa mbutuhaké 8–10 gelas (watara rong liter) saben dina,[15] nanging asil penlitèn kang diterbitaké Universitas Pennsylvania nalika taun 2008 nuduhaké yèn konsumsi 8 gelas mau ora kabukti mbantu akèh sajeroning nyehataké awak.[16] Malah sok-sok kanggo sapérangan wong, yèn ngombé banyu luwih akèh utawa kaluwihan saka kang kaprayogakaké bisa njalari katergantungan. Literatur médhis liyané nyaranaké konsumsi saliter banyu saben dina, kanthi tambahan yèn ulah raga utawa nalika cuaca kang panas.[17]
Pelarut
[besut | besut sumber]Pelarut digunakaké sadina-dina kanggo ngumbahi, contoné ngumbah awak manungsa (adus), sandhangan, jogan, montor, panganan, lan kéwan. Saliyané iku, limbah rumah tangga uga digawa déning banyu liwat saluran pambuwangan. Ing nagara-nagara indhustri, sapérangan gedhé banyu kagunakaké minangka pelarut.
Banyu bisa dadi fasilitas prosès biologi kang nglarutaké limbah. Mikroorganisme kang ana ing njero banyu bisa mbantu mecah limbah dadi dat-dat kanthi tingkat polusi kang luwih asor.
Zona biologis
[besut | besut sumber]Banyu wujud cuwèran singular, amarga kapasitasé kanggo minangka jaringan molekul 3 dhimènsi mawa ikatan hidrogen kang mutual. Iki disebabaké amarga saben molekul banyu duwé 4 momotan fraksional kanthi arah tetrahedron, 2 momotan positif saka kaloro atom hidrogen lan loro momotan négatif saka atom oksigèn.[18] Akibaté, saben molekul banyu bisa minangka 4 ikatan hidrogen karo molekul ing saubengé. Minangka conto, sawijining atom hidrogen kang manggon ing antarané loro atom oksigèn, bakal minangka siji ikatan kovalen karo siji atom oksigèn lan siji ikatan hidrogen karo atom oksigèn liyané, kaya kang dumadi ing ès. Owah-owahan dhènsitas molekul banyu bakal mangaruhi kamampuané kanggo nglarutaké partikel. Amarga sipat momotan fraksional molekul, lumrahé, banyu wujud dat pelarut kang apik kanggo partikel mawa momotan utawa ion, nanging ora kanggo senyawa hidrokarbon.
Konsèp ngenani sèl minangka larutan kang kebuntel membran, pisanan disinaoni déning èlmuwan Ruslan kang jenengé Troschin nalika taun 1956. Nalika monografé, Problems of Cell Permeability, tesis Troschin nélakaké yèn partisi larutan kang dumadi antarané lingkungan intraselular lan èkstraselular ora mung ditemtokaké déning permeabilitas membran, nanging dumadi akumulasi larutan tinentu ing njero protoplasma, saéngga minangka larutan gèl kang béda karo banyu murni.
Nalika taun 1962, Ling liwat monografé, A physical theory of the living state, njlèntrèhaké yèn banyu kang kakandhut ing njero sèl ngalami polarisasi dadi lapisan-lapisan kang nylimuti lumahing protèin lan wujud pelarut kang ala kanggo ion. Ion K+ diserep déning sèl normal, sebab gugus karboksil saka protèin cenderung kanggo narik K+ tinimbang ion Na+. Téyori iki, ditepungi minangka hipotèsis induksi-asosiasi uga njlèntrèhaké ora anané kompa kation, ATPase, kang kaiket ing mèmbran sèl, lan distribusi kabèh larutan ditemtokaké déning kombinasi saka gaya silih tarik antarané saben protèin kanthi modhifikasi sipat larutan banyu sajeroning sèl. Asil saka pangukuran NMR pancèn nuduhaké mudhuné mobilitas banyu ing njero sèl nanging kanthi rikat kadifusi karo molekul banyu normal. Iki banjur ditepungi minangka modhèl two-fraction, fast-exchange.
Anané kompa kation kang diobahaké déning ATP ing mèmbran sèl, terus dadi bahan perdebatan, bebarengan karo perdebatan ngenani karakteristik cuwèran ing njero sitoplasma lan banyu normal lumrahé. Argumèntasi paling kuwat kang nentang téyori ngenani jinis banyu kang mirunggan ing njero sèl, asalé saka kalangan ahli kimiawan fisis. Para ahli mau duwé pendhapat yèn banyu ing njero sèl ora mungkin béda karo banyu normal, saéngga owah-owahan struktur lan karakter banyu intrasélular uga bakal dialami karo banyu èkstraselular. Pendhapat iki didhasaraké marang pamikiran yèn, sanajan yèn kompa kation bener ana kaiket ing mèmbran sèl, kompa mau mung nyiptakaké kasetimbangan osmotik sélular kang misahaké siji larutan saka larutan liya, nanging ora kanggo banyu. Banyu ingaran duwé kasetimbangan dhéwé kang ora bisa diwatesi déning mèmbran sèl.
Para ahli liya kang duwé pendhapat yèn banyu ing njero sèl béda banget karo banyu lumrahé. Banyu kang dadi ora bébas obah amarga prabawa lumahing ionik, ingaran minangka banyu mawa iket (Inggris: bound water), éwadéné banyu sanjaban jangkowan prabawa ion mau diarani banyu bébas (Inggris: bulk water).
Banyu kaiket bisa énggal nglarutaké ion, amarga saben jinis ion bakal énggal katarik déning saben momotan fraksional molekul banyu, saéngga kation lan anion bisa ana cecedhakan tanpa kudu minangka garam. Ion luwih gampang kahidrasi déning banyu kang réaktif, padhet kanthi iketan ora kenceng, tinimbang banyu inert ora padhet kanthi daya ikat kuwat. Iki nyiptakaké zona banyu, minangka conto, kation cilik kang kahidrasi banget bakal cenderung kaakumulasi ing fase banyu kang luwih padhet, éwadéné kation kang luwih gedhé bakal cenderung kaakumulasi ing fase banyu kang luwih renggang, lan nyiptakaké partisi ion kaya sérial Hofmeister ing ngisor iki:
- Mg2+ > Ca2+ > H+ >> Na+
- NH+ > Cs+ > Rb+ > K+
- ATP3- >> ATP2- = ADP2- = HPO42-
- I- > Br- > Cl- > H2PO4-
cathetan
- dhènsitas banyu kaiket tansaya dhuwur menyang arah tengen.
Interaksi antarané molekul banyu kaikat lan gugus ionik diasumsikaké dumadi ing rentang let kang cendhak, saéngga atom hidrogen kaorièntasi menyang arah anion lan nyandhet interaksi antarané populasi banyu kaiket karo banyu bébas. Orièntasi molekul banyu kaiket tansaya winates lumahing molekul polielektrolit mawa momotan négatif antarané DNA, RNA, asem hialorunat, kondroitin sulfat, lan jinis biopolimèr kanthi momotan liya. Energi elektrostatik antarané molekul biopolimer mawa momotan padha kang silih dhesek bakal nyiptakaké gaya hidrasi kang nyurung molekul banyu bébas metu saka njero sitoplasma.
Lumrahé, konsènstrasi larutan polièlèktrolit kang cukup dhuwur bakal minangka gèl. Umpamané gèl agarose utawa gèl saka asem hialuronat kang ngandhut 99,9% banyu saka total bobot gèl. Ketahané molekul banyu ing njero struktur kristal gèl wujud salah siji conto kacenderungan alami saben komponèn saka sawijining sistem kanggo campur kanthi rata. Molekul banyu bisa ucul saka gèl minangka rèspon saka tekanan udara, paningkatan suhu utawa liwat mékanisme panguwapan, nanging kanthi mudhuné rasio kandhutan banyu, daya iket ionik kang dumadi antarané molekul dat kalarut kang nahan molekul banyu bakal tansaya kuwat.
Sanajan mangkoko, panyerakan ionik kaya iki isih durung bisa njelasaké sapérangan fénoména anomali larutan kaya déné,
- prabédan sipat banyu ing njero sitoplasma oosit kéwan kodhok karo banyu ing njero inti sèl lan banyu normal
- mudhuné koéfisièn difusi banyu ing njero Artemia cyst dibandhingaké karo koéfisièn banyu kang padha ing gèl agarose lan banyu normal
- luwih cendhèké dhènsitas banyu ing Artemia cyst dibandhingaké banyu normal ing suhu kang padha
- anomali trimetilamina oksida ing jaringan otot
- kaloro kandhungan banyu normal, lan banyu mawa koéfisièn partisi 1,5 kang diduwèni mitokondria ing suhu 0-4 °C
Fénoména anomali larutan iki dianggep dumadi ing rentang let adoh kang ana ing njaba dhomain panyerakan ionik.
Ènèrgi ing molekul banyu dadi dhuwur amarga iketan hidrogen kang diduwèni dadi ora maksimal, kaya déné nalika molekul banyu ana saceraking lumahan utawa gugus hidrokarbon. Senyawa hidrokarbon banjur diarani asifat hidrofobik sebab ora minangka iketan hidrogen karo molekul banyu. Daya iket hidrogen ing kaanan iki bakal nembus sapérangan zona banyu lan partisi ion, saéngga disebutaké yèn minangka karakter banyu ing rentang let adoh. Ing rentang iki, molekul garam kaya déné Na2SO4, sodium asetat lan sodium fosfat bakal duwé kacenderungan kanggo kaurai dadi kation Na+ lan anioné.
Banyu sajeroning kasenian
[besut | besut sumber]
- Artikel utama: Air sajeroning kasenian
Sajeroning seni banyu disinaoni kanthi cara kang béda, banyu disajèkaké minangka sawijining èlemèn langsung, ora langsung utawa uga mung minangka simbul. Kanthi dijurung kamajuwan tèknologi fungsi lan pamupangatan banyu sajeroning seni wiwit owah, saka mauné geganep banyu wiwit mrambat dadi obyèk utama. Conto seni kang pungkasan iki, umpamané seni ilènan utawa tètèsan (sculpture liquid utawa droplet art).[19]
Seni lukis
[besut | besut sumber]Nalika jaman Renaisans lan sawisé iku, banyu diréprésentasikaké luwih réalistis. Akèh artis nggambaraké banyu sajeroning wangun obah-sawijining ilènan banyu utawa kali, sawijining sagara kang turbulensi, utawa malah grojogan-nanging akèh uga saka artis-artik iku kang seneng karo obyèk-obyèk banyu kang anteng, meneng-tlaga, kali kang mèh ora mili, lan lumahing sagara kang ora ngombak. Sajeroning saben kasus iki, banyu nemtokaké swasana (mood) kabèh karya seni mau,[20] kaya ta umpamané sajeroning Birth of Venus (1486) karya Botticelli[21] lan The Water Lilies (1897) karya Monet.[22]
Fotografi
[besut | besut sumber]Selaras karo majuning tèknologi sajeroning seni, banyu wiwit njupuk papan sajeroning babagan seni liya, umpamané sajeroning fotografi. Sanajan ana banyu ora duwé teges mirunggan ing kéné lan mung duwé peran minangka èlemèn palengkap, nanging banyu bisa digunakaké sajeroning mèh kabèh cabang fotografi: wiwit saka fasion nganti landsekap. Motrèt banyu minangka èlemèn sajeroning obyèk mbutuhaké pananganan mirunggan, wiwit saka filter circular polarizer kang migunani kanggo ngilangaké réflèksi, nganti pamupangatan tèhnik long exposure, sawijining tèhnik fotografi kang ngandhalaké bukaan rana alon kanggo ngripta èfèk lembut (soft) ing lumahing banyu.[23]
Seni tètèsan banyu
[besut | besut sumber]Kaéndahan tètèsan banyu kang mecah lumahing banyu kang ana ing sangisoré dilestarèkaké kanthi manéka sentuhan tèhnik lan rasa ndadèkaké sawijining karya seni kang éndah, kaya déné kang disajèkaké déning Martin Waugh sajeroning karyané Liquid Sculpture, sawijining antologi kang wis madonya.[24]
Seni tètèsan banyu ora mandheg tekan kéné, kanthi pamupangatan tèhnik pangaturan marang tibané tètèsan banyu kang malar, tètèsan-tètèsan banyu bisa diowahi samengkono rupané saéngga tètèsan-tètèsan mau minangka sawijining kamanunggalan duwé fungsi minangka sawijining penampil (viewer) kaya déné tampilan komputer. Kanthi ngatur-atur ukuran lan gunggung tètèsan kang bakal diliwataké, bisa sawijining gambar ditampilaké déning tètèsan-tètèsan banyu kang tiba. Èmané gambar iki mung asifat sauntara, tekan titik kang dikarepaké tiba nggayuh pérangan ngisor penampil.[25] Komersialisasi karya jinis iki uga sajeroning wangun résolusi kang luwih kasar wis akèh dilakokaké.[26][27]
Rujukan
[besut | besut sumber]Artikel rujukan
[besut | besut sumber]- ↑ Philip Ball, Water and life: Seeking the solution, Nature 436, 1084-1085 (25 August 2005) | doi:10.1038/4361084a
- ↑ Water - The Essential Substance, Experimental Lakes Area, University of Manitoba
- ↑ What are the Essential Ingredients of Life? Archived 2014-06-06 at the Wayback Machine., Natural History Museum, California Academy of Sciences
- ↑ Steven A Benner, Water is not an essential ingredient for Life, scientists now claim, SpaceRef.com[pranala mati permanèn], uplink.space.com Archived 2007-11-09 at the Wayback Machine.
- ↑ [Michael Kwan, Prototype car runs 100 miles on four ounces of water as fuel, Mobile Magazine Thursday June 1, 2006 6:41 AM PDT]
- ↑ "Archive copy". Diarsip saka sing asli ing 2007-06-06. Dibukak ing 2011-03-03.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ [Peter Tyson, Life's Little Essential, NOVA, Origins, July 2004]
- ↑ Peter Tyson, Life's Little Essential, NOVA, Origins, July 2004
- ↑ H.E. Msgr. Renato R. Martino, Water, an Essential Element of Life, A Contribution of the Delegation of the Holy See on the Occasion of the third World Water Forum, Kyoto, Japan, 16th-23rd March 2003
- ↑ Michael Kwan, Prototype car runs 100 miles on four ounces of water as fuel, Mobile Magazine Thursday June 1, 2006 6:41 AM PDT Archived March 6, 2007, at the Wayback Machine.
- ↑ Fuel from "Burning Water", KeelyNet 01/09/02 Archived 2007-03-23 at the Wayback Machine.
- ↑ Hydrogen Technologies
- ↑ "Physical Forces Organizing Biomolecules (PDF)" (PDF). Diarsip saka sing asli (PDF) ing 2004-10-11. Dibukak ing 2011-12-14.
- ↑ Re: What percentage of the human body is composed of water? Jeffrey Utz, M.D., The MadSci Network
- ↑ "Healthy Water Living". BBC. Diarsip saka asliné ing 2012-05-24. Dibukak ing 1 Fèbruari 2007.
- ↑ "Lots of water 'is little benefit'". BBC. Dibukak ing 6 April 2008.
- ↑ RA Rhoades, GA Tanner (2003). Medical Physiology (édhisi ka-second). Baltimore: Lippincott Williams & Wilkins. ISBN 0781719364.
- ↑ "Role of Water in Some Biological Processes" (pdf). Department of Medicine, University of Auckland School of Medicine; PHILIPPA M. WIGGINS. Dibukak ing 2010-11-09.
- ↑ (ing basa Itali) Lucio V. Mandarini, "Liquide sculture", FotoCult, Novembre 2006, pagina 60-65
- ↑ Chris Witcombe, Water in Art, H2O-The Mystery, Art, and Science of Water, art.html Archived 2021-12-08 at the Wayback Machine., 21.03.2007 13:32:20
- ↑ Birth of Venus (1486) Archived 2006-11-09 at the Wayback Machine., Water in art, Water Institute-Nestlé Waters M.T. 2005
- ↑ The Water Lilies cycle by Monet Archived 2006-11-09 at the Wayback Machine., Water in art, Water Institute-Nestlé Waters M.T. 2005
- ↑ Email Arief Setiawan kepada Nein Arimasen, Wed, 21 Mar 2007 09:04:07 +0700 (WIT). Arief Setiawan ya iku seorang juru foto.
- ↑ Martin Waugh, Liquid Sculpture, 2007; video DivX[pranala mati permanèn]
- ↑ Water Droplet Art, Twiddly Bits, August 23rd, 2005 at 9:07 pm, Bitfall Simulation kriegte 50% Realität, Auszeichnung für Innovation und Technik-Kunstförderpreis der Stadtwerke Halle und Leipzig, Halle, 2004
- ↑ "Jeep waterfall - DIY version?". Diarsip saka sing asli ing 2007-04-03. Dibukak ing 2012-01-24.
- ↑ Pictures and Video Archived 2007-02-28 at the Wayback Machine., Pevnick Design Inc.
Rujukan umum
[besut | besut sumber]- OA Jones, JN Lester and N Voulvoulis, Pharmaceuticals: a threat to drinking water? TRENDS in Biotechnology 23(4): 163, 2005
- Franks, F (Ed), Water, A comprehensive treatise, Plenum Press, New York, 1972-1982
- Property of Water and Water Steam w Thermodynamic Surface
- PH Gleick and associates, The World's Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. (published every two years, beginning in 1998.)
- Marks, William E., The Holy Order of Water: Healing Earth's Waters and Ourselves. Bell Pond Books (a div. of Steiner Books), Great Barrington, MA, November 2001 [ISBN 0-88010-483-X]
Banyu minangka sumber daya alam alami
[besut | besut sumber]- Gleick, Peter H. The World's Water: The Biennial Report on Freshwater Resources. Washington: Island Press. (November 10, 2006)| ISBN 978-1-59726-105-0]
- Postel, Sandra (1997). Last Oasis: Facing Water Scarcity (édhisi ka-2). New York: Norton Press.
- Anderson (1991). Water Rights: Scarce Resource Allocation, Bureaucracy, and the Environment.
- Marq de Villiers (2003). Water: The Fate of Our Most Precious Resource (édhisi ka-revised).
- Diane Raines Ward (2002). Water Wars: Drought, Flood, Folly and the Politics of Thirst.
- Miriam R. Lowi (1995). Water and Power: The Politics of a Scarce Resource in the Jordan River Basin. (Cambridge Middle East Library)
- Worster, Donald (1992). Rivers of Empire: Water, Aridity, and the Growth of the American West.
- Reisner, Marc (1993). Cadillac Desert: The American West and Its Disappearing Water.
- Maude Barlow, Tony Clarke (2003). Blue Gold: The Fight to Stop the Corporate Theft of the World's Water.
- Vandana Shiva (2002). Water Wars: Privatization, Pollution, and Profit. ISBN 0-7453-1837-1.
- Anita Roddick; et al. (2004). Troubled Water: Saints, Sinners, Truth And Lies About The Global Water Crisis.
- William E. Marks (2001). The Holy Order of Water: Healing Earths Waters and Ourselves.
Wacan terusan
[besut | besut sumber]- J. Lobaugh and Gregory A. Voth, A quantum modhèl for water: Equilibrium and dynamical properties, The Journal of Chemical Physics -- February 8, 1997 -- Volume 106, Issue 6, pp. 2400-2410 doi:10.1063/1.473151
- Kyoko Watanabe and Michael L. Klein, Effective pair potentials and the properties of water, Chemical Physics Volume 131, Issues 2-3 , 15 March 1989, Pages 157-167 doi:10.1016/0301-0104(89)80166-1
- Frank H. Stillinger and Aneesur Rahman, Improved simulation of liquid water by molecular dynamics, The Journal of Chemical Physics -- February 15, 1974 -- Volume 60, Issue 4, pp. 1545-1557 doi:10.1063/1.1681229
- R. J. Speedy and C. A. Angell, Isothermal compressibility of supercooled water and evidence for a thermodynamic singularity at –45 °C, The Journal of Chemical Physics -- August 1, 1976 -- Volume 65, Issue 3, pp. 851-858 doi:10.1063/1.433153
Uga delengen
[besut | besut sumber]| Wikimedia Commons duwé médhia ngenani Water. |

- Banyu
- Banyu asin
- Siklus banyu
- Méga
- Banjir
- Ès
- Embun
- Tlaga
- Hidrologi
- Ujan
- Laut
- Salju
- Kali
- Desalinasi
- Osmosis
- Osmosis kawalik
- Kabèh artikel mawa pranala njaba sing mati
- Artikel mawa pranala njaba sing mati kawit September 2023
- Articles with invalid date parameter in template
- Artikel mawa pranala njaba sing mati permanèn
- CS1 maint: archived copy as title
- Artikel mawa pranala njaba basa Itali
- Artikel mawa pranala njaba sing mati kawit October 2023
- Artikel ngandhut tulisan abasa mawa sitiran basa Inggris
- Artikel pethingan
- Ombèn-ombèn
- Hidrida
- Banyu
- Dat kimiya

