Atom
| Atom hèliyum | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ilustrasi atom hèliyum kang nuduhaké inti atom (abang nom) lan distribusi awan èlèktron (ireng). Inti atom (tengen ndhuwur) awangun simètris bunder, kanggo inti atom kang luwih rumit ora tansah kaya mangkono. | ||||||||
| Klasifikasi | ||||||||
| ||||||||
| Sipat-sipat | ||||||||
|
Atom ya iku ékan dhasar matèri, kang kasusun saka inti atom lan uga èlèktron minangka momotan négatif kang ngubengi.[1] Inti atom kasusun saka proton kang muatané positif, lan neutron kang muatané nétral.[1] Èlèktron-èlèktron kang ana ing siji atom kajiret ana ing inti atom déning gaya èlèktromagnètik.[1] Sakumpulan atom iku bisa gegandhèngan siji klawan liyané lan minangka siji molekul.[1] Atom kang ana kandhutané proton lan èlèktron kang padha sipaté nétral, déné kang duwÉ kandhutan proton lan èlèktron kang béda sipat positif utawa négatif lan dijenengi ion.[1] Atom diklompokaké miturut gunggung proton lan neutron kang ana ing inti atom iku.[1] Gunggung proton ana ing atom nentokaké unsur kimia atom iku, lan jumlah neutron nentukaké isotop unsur iku. [1] Istilah atom asalé saka Basa Yunani (ἄτομος/átomos, α-τεμνω), kang tegesé ora bisa ditugel utawa ora bisa dibagi-bagi.[2] Konsèp atom dadi komponèn kang ora bisa dibagi-bagi manèh pisanan diajokaké déning filsuf India lan Yunani.[2] Ana ing abad kaping 17 lan kaping 18, para kimiawan nentokaké dhasar-dhasar pamikiran iki kanthi nuduhaké siji dat-dat kang ora bisa dibagi-bagi manèh nganggo métodhe-métodhe kimia.[2] Nganti tekan pungkasaning abad kaping 19 lan wiwitan abad kaping 20, para fisikawan bisa nemu struktur lan komponèn-komponèn subatom ana ing sajeroné atom, iki mbuktèkaké yèn atom dudu ora bisa dibagi manèh.[2] Prinsip-prinsip mékanika kuantum kang digunakaké para fisikawan banjur bisa gawé modhèl atom.[2]
Sajarah
[besut | besut sumber]Konsèp yèn matèri kapérang saka ékan-ékan kapisah kang ora bisa dibagi manèh dadi ékan kang luwih cilik wis ana suwéné sakmilenium. Nanging, pamikiran mau isih asifat abstrak lan filosofis, tinimbang dhedhasar pangamatan èmpiris lan èkspèrimèn. Sacara filosofis, dhèskripsi sipat-sipat atom manéka variasi gumantung ing budaya lan ilènan filosofi mau, lan asring uga ngandhung unsur-unsur spiritual ing njeroné. Sanajan mangkono, pamikiran dhasar ngenani atom bisa ditampa déning para èlmuwan èwonan taun sabanjuré, amarga dhèwèké kanthi èlegan bisa njelasaké panemon-panemon anyar ing babagan kimia.[3]
Rujukan paling awal ngenani konsèp atom bisa ditilik manèh ing jaman India kuna nalika taun 800 sadurungé masèhi,[4] kang dijelasaké sajeroning naskah filsafat Jainisme minangka anu lan paramanu.[4][5] Ilènan madahab Nyaya lan Vaisesika ngembangaké téyori kang njelasaké kepriyé atom-atom nggabung dadi bandha-bandha kang luwih komplèks.[6] Saabad sabanjuré mijil rujukan ngenani atom ing donya Kulon déning Leukippos, kang sabanjuré déning muridé Demokritos pandhangan mau disistematisaké. Kira-kira nalika taun 450 SM, Demokritos nyiptakaké istilah átomos (Grikenlan: ἄτομος), kang ateges "ora bisa ditugel" utawa uga "ora bisa dibagi-bagi manèh". Téyori Demokritos ngenani atom dudu usaha kanggo njlèntrèhaké siji fénoména fisis kanthi rinci, nanging siji filosofi kang nyoba kanggo mènèhi jawaban marang owah-owahan kang dumadi ing alam.[2] Filosofi sarupa uga dumadi ing India, sanajan mangkono ngèlmu pangetauan modhèren mutusaké kanggo migunakaké istilah "atom" kang dicetusaké déning Demokritos.[3]
Kamajuan luwih adoh ing pamahaman babagan atom diwiwiti kanthi ngrembakané ngèlmu kimia. Nalika taun 1661, Robert Boyle mublikasikaké buku The Sceptical Chymist kang duwé argumèn yèn matèri-matèri ing donya iki kapérang saka manéka kombinasi "corpuscules", ya iku atom-atom kang béda. Iki béda karo pandelengan klasik kang duwé pendhapat yèn matèri kapérang saka unsur-unsur udara, lemah, geni, lan banyu.[7] Nalika taun 1789, istilah element (unsur) didhéfinisikaké déning siji bangsawan lan panliti Prancis, Antoine Lavoisier, minangka bahan dhasar kang ora bisa dibagi-bagi luwih adoh manèh kanthi migunakaké métodhe-métodhe kimia.[8]

Nalika taun 1803, John Dalton migunakaké konsèp atom kanggo njlèntrèhaké ngapa unsur-unsur mesthi silih réaksi sajeroning pabandhingan kang bulat lan tetep, sarta ngapa gas-gas tinentu luwih larut sajeroning banyu dibandhingaké karo gas-gas liyané. Dhèwèké ngajokaké pendhapat yèn saben unsur ngandhut atom-atom tunggal unik, lan atom-atom mau sabanjuré bisa rumaket kanggo minangka senyawa-senyawa kimia.[9][10]
Téyori partikel iki banjur dikonfirmasikaké luwih adoh manèh nalika taun 1827, ya iku nalika botaniwan Robert Brown migunakaké mikroskop kanggo ngamati lebu-lebu kang ngambang ing sandhuwuré banyu lan nemu yèn lebu-lebu mau obah kanthi acak. Fénoména iki banjur ditepungi minangka "Gerak Brown". Nalika taun 1877, J. Désaulx ngajokaké pendhapat yèn fénoména iki disebabaké déning obahan tèrmal molekul banyu, lan nalika taun 1905 Albert Einstein gawé analisis matématika tumrap obah iki.[11][12][13] Fisikawan Prancis Jean Perrin banjur migunakaké asil makarya Einstein kanggo nemtokaké massa lan dhimènsi atom kanthi èkspèrimèn, kang banjur kanthi pesthi dadi vèrifikasi tumrap téyori atom Dalton.[14]
Adhedhasar asil panalitèné marang sinar katode, nalika taun 1897 J. J. Thomson nemu èlèktron lan sipat-sipat subatomiké. Iki ngruntuhaké konsèp atom minangka ékan kang ora bisa dibagi-bagi manèh.[15] Thomson percaya yèn èlèktron-èlèktron kadhistribusi kanthi rata ing saindhenging atom, lan momotan-muatané diseimbangaké déning anané lautan momotan positif (modhèl pudhing prem).
Nanging nalika taun 1909, para panliti ing sangisoré arahan Ernest Rutherford némbakaké ion hélium menyang lembaran tipis emas, lan nemu yèn sapérangan cilik ion mau dipantulaké kanthi pojok pantulan kang luwih lancip saka apa kang diprédhiksikaké déning téyori Thomson. Rutherford banjur ngajokaké pendhapat yèn momotan positif siji atom lan akèh-akèhé massané kakonsèntrasi ing inti atom, kanthi èlèktron kang ngupengi inti atom kaya déné planit ngupengi srengéngé. Muatan positif ion hélium kang ngliwati inti padhet iki kudu dipantulaké kanthi pojok pantulan kang luwih lancip. Nalika taun 1913, nalika lagi èkspèrimèn kanthi asil prosès paluruhan radhioaktif, Frederick Soddy nemu yèn ana punjul sakjinis atom ing saben posisi tabèl périodhik.[16] Istilah isotop banjur diciptakaké déning Margaret Todd minangka jeneng kang trep kanggo atom-atom kang béda nanging wujud siji unsur kang padha. J.J. Thomson sabanjuré nemu tèhnik kanggo misahaké jinis-jinis atom mau lumantar asil kerjané ing gas kang kaionisasi.[17]
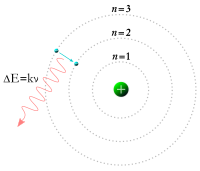
Sauntara iku, nalika taun 1913 fisikawan Niels Bohr nglakokaké kajian ulang modhèl atom Rutherford lan ngajokaké pendhapat yèn èlèktron-èlèktron ana ing orbit-orbit kang kakuantisasi sarta bisa mlumpat saka siji orbit menyang orbit liyané, sanajan mangkono ora bisa kanthi bébas muter spiral lumebu utawa metu sajeroning kaanan transisi.[18] Sawijining èlèktron kudu nyerep utawa uga mancaraké sapérangan ènèrgi tinentu kanggo bisa nglakokaké transisi antarané orbit-orbit kang tetep iki. Yèn cahya saka matèri kang dipanasaké mancar lumantar prisma, dhèèwèké ngasilaké siji spèktrum multiwerna. Paningalan garis-garis spèktrum tinentu iki kasil dijlèntrèhaké déning téyori transisi orbital iki.[19]
Banjur ing taun 1916, roncèn kimia antar atom dijlèntrèhaké déning Gilbert Newton Lewis minangka interaksi antarané èlèktron-èlèktron atom mau.[20] Amarga ana tematané sipat-sipat kimiawi sajeroning tabèl périodhe kimia,[21] kimiawan Amérika Irving Langmuir taun 1919 duwé pendhapat yèn iki bisa dijlèntrèhaké yèn èlèktron-èlèktron ing siji atom silih gegandhèngan utawa kumpul sajeroning wangun-wangun tinentu. Saklompok èlèktron diprakirakaké nglungguhi saksèt kelopak èlèktron ing saubengé inti atom.
Panjanjalan Stern-Gerlach nalika taun 1922 mènèhaké bukti luwih adoh babagan sipat-sipat kuantum atom. Nalika sakberkas atom pérak ditembakaké lumantar médhan magnèt, berkas mau kapisah-pisah selaras karo arah momèntum pojok atom (spin). Amarga arah spin iku acak, berkas iki diarepaké nyebar dadi sakgaris. Nanging ing kasunyatané berkas iki kapérang dadi rong pérangan, gumantung saka apa spin atom mau duwé orièntasi munggah utawa uga mudhun.[22]
Nalika taun 1926, kanthi migunakaké pamikiran Louis de Broglie yèn partikel kanthi prilaku kaya déné gelombang, Erwin Schrödinger ngrembakakaké siji modhèl atom matématis kang nggambaraké èlèktron minangka gelombang telung dhimènsi tinimbang minangka titik-titik partikel. Konsekuènsi panggunakan wangun gelombang kanggo njlèntrèhaké èlèktron iki ya iku yèn ora mungkin kanggo kanthi matématis ngétung posisi lan momèntum partikel kanthi bebarengan. Iki banjur ditepungi minangka prinsip kaoramesthinan, kang dirumusaké déning Werner Heisenberg nalika taun 1926. Miturut konsèp iki, kanggo saben pangukuran siji posisi, siji wong mung bisa éntuk kisaran pangaji-pangaji probabilitas momèntum, mangkono uga suwaliké. Sanajan modhèl iki angèl kanggo divisualisasikaké, dhèwèké bisa kanthi becik njlèntrèhaké sipat-sipat atom kang kadeleng kang sadurungé ora bisa dijlèntrèhaké déning téyori ngendi waé. Mula, modhèl atom kang nggambaraké èlèktron ngupengi inti atom kaya déné planit ngupengi srengéngé diguguraké lan digantèkaké déning modhèl orbital atom ing saubengé inti ing ngendi èlèktron paling mungkin ana.[23][24]

Perkembangan ing spèktromètri massa ngidinaké dilakokaké pangukuran massa atom kanthi pas. Piranti spèktromèter iki migunakaké magnèt kanggo mbélokaké trayèktori berkas ion, lan akèhé deflèksi ditemtokaké kanthi rasio massa atom tumrap muatané. Kimiawan Francis William Aston migunakaké piranti iki kanggo nuduhaké yèn isotop duwé massa kang béda. Prabédan massa antar isotop iki wujud wilangan bulat, lan dhèwèké ingaran minangka kaidah wilangan bulat.[25] Panjlèntrèhan ing prabédan massa isotop iki kasil dipecahaké sawisé tinemu neutron, siji partikel mawa momotan nétral kanthi massa kang mèh padha karo proton, ya iku déning James Chadwick nalika taun 1932. Isotop banjur dijlèntrèhaké minangka unsur kanthi gunggung proton kang padha, nanging duwé gunggung neutron kang béda sajeroning inti atom.[26]
Nalika taun 1950-an, ngrembakané panyepet partikel lan dhetèktor partikel ngidinaké para èlmuwan nyinaoni dhampak-dhampak saka atom kang obah kanthi ènèrgi kang dhuwur.[27] Neutron lan proton banjur dikawruhi minangka hadron, ya iku komposit partikel-partikel cilik kang ingaran minangka kuark. Modhèl-modhèl standhar fisika nuklir banjur dikembangaké kanggo njelasaké sipat-sipat inti atom sajeroning babagan interaksi partikel subatom iki.[28]
Watara taun 1985, Steven Chu sarèncang ing Bell Labs ngrembakakaké siji tèhnik kanggo ngedhunaké tèmperatur atom migunakaké laser. Ing taun kang padha, saklompok èlmuwan kang diketuwai déning William D. Phillips kasil nyekel atom natrium sajeroning prangkap magnèt. Claude Cohen-Tannoudji banjur nggabungaké kaloro tèhnik mau kanggo ngedhemaké sapérangan cilik atom nganti sapérangan mikrokelvin. Iki ngidinaké èlmuwan nyinaoni atom kanthi présisi kang dhuwur banget, kang ing tembé wuri nggawa para èlmuwan nemu kondhènsasi Bose-Einstein.[29]
Ing sajarahé, siji atom tunggal cilik banget kanggo dipigunakaké sajeroning aplikasi èlmiah. Nanging saiki, manéka piranti kang migunakaké siji atom tunggal logam kang digandhèngaké karo ligan-ligan organik (transistor èlèktron tunggal) wis digawé.[30] Manéka panlitèn wis dilakokaké kanggo mrangkap lan ngalonaké laju atom migunakaké pangadheman laser kanggo ngéntukaké pamahaman kang luwih becik ngenani sipat-sipat atom.[31]
Komponèn-komponèn atom
[besut | besut sumber]Partikel subatom
[besut | besut sumber]Sanajan wiwitané tembung atom tegesé siji partikel kang ora bisa ditugel-tugel manèh dadi partikel kang luwih cilik, sajeroning tèrminologi ngèlmu kawruh modhèren, atom kasusun saka manéka partikel subatom. Partikel-partikel panyusun atom iki ya iku èlèktron, proton, lan neutron. Nanging hidrogen-1 ora duwé neutron. Mangkono uga ing ion hidrogen positif H+.
Saka kabèh partikel subatom iki, èlèktron iku kang paling ènthèng, kanthi massa èlèktron 9,11 × 10−31 kg lan duwé momotan négatif. Ukuran èlèktron cilik banget mula durung ana tèhnik pangukuran kang bisa dipigunakaké kanggo ngukur ukurané.[32] Proton duwé momotan positif lan massa kaping 1.836 luwih abot tinambang èlèktron (1,6726 × 10−27 kg). Neutron ora duwé momotan listrik lan massa bébasé kaping 1.839 massa èlèktron[33] atau (1,6929 × 10−27 kg).
Sajeroning modhèl standhar fisika, proton lan neutron kapérang saka partikel èlemèntèr kang ingaran kuark. Kuark kalebu sajeroning golongan partikel fermion lan wujud salah siji saka rong bahan panyusun matèri dhasar (kang liyané ya iku lepton). Ana enem jinis kuark lan saben kuark mau duwé momotan listrik fraksional +2/3 utawa uga −1/3. Proton kapérang saka rong kuark munggah lan siji kuark mudhun, nalika neutron kapérang saka siji kuark munggah lan loro kuark mudhun. Prabédan komposisi kuark iki mangaruhi prabédan massa lan momotan antarané kaloro partikel mau. Kuark rinoncé bebarengan déning gaya nuklir kuwat kang diprantarani déning gluon. Gluon iku anggota saka boson tolok kang wujud prantara gaya-gaya fisika.[34][35]
Inti atom
[besut | besut sumber]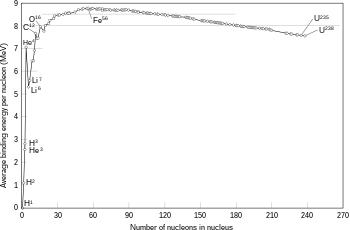
Inti atom kapérang saka proton lan neutron kang karoncé bebarengan ing punjer atom. Sacara kolèktif, proton lan neutron mau diarani nukleon (partikel panyusun inti). Dhiamèter inti atom watara 10−15 tekan 10−14m.[36] Driji-driji inti diprakirakaké padha karo fm, kanthi A iku gunggung nukleon.[37] Iki cilik banget dibandhingaké karo driji-driji atom. Nukleon-nukleon mau karoncé bebarengan déning gaya silih tarik potènsial kang ingaran gaya kuwat résidual. Ing let luwih cilik saka 2,5 fm, gaya iki luwih kuwat saka gaya èlèktrostatik kang njalari proton silih tolak.[38]
Atom saka unsur kimia kang padha duwé gunggung proton kang padha, ingaran nomer atom. Sawijining unsur bisa duwé gunggung neutron kang manéka variasiné. Variasi iki ingaran minangka isotop. Gunggung proton lan neutron siji atom bakal nemtokaké nuklida atom mau, éwadéné gunggung neutron rélatif marang gunggung proton bakal nemtokaké stabilitas inti atom, kanthi isotop unsur tinentu bakal nglakokaké paluruhan radhioaktif.[39]
Neutron lan proton iku rong jinis fermion kang béda. Asas pangecualian Pauli nglarang anané fermion kang idhèntik (kaya déné umpamané proton gandha) nglungguhi siji kaanan fisik kuantum kang padha ing wektu kang padha. Mula saka iku, saben proton sajeroning inti atom kuduné nglungguhi kaanan kuantum kang béda karo aras ènèrginé dhéwé-dhéwé. Asas Pauli iki uga lumaku kanggo neutron. Palarangan iki ora lumaku kanggo proton lan neutron kang nglungguhi kaanan kuantum kang padha.[40]
Kanggo atom kanthi nomer atom kang cendhèk, inti atom kang duwé gunggung proton luwih akèh saka neutron duwé potènsi tiba menyang kaanan ènèrgi kang luwih cendhèk lumantar paluruhan radhioaktif kang njalari gunggung proton lan neutron imbang. Mula saka iku, atom kanthi gunggung proton lan neutron kang imbang luwih stabil lan ora bakal ngluruh. Nanging, kanthi ningkaté nomer atom, gaya silih tulak antar proton agawé inti atom mbutuhaké proporsi neutron kang luwih dhuwur manèh kanggo njaga stabilitasé. Ing inti kang paling abot, rasio neutron per proton kang diperlokaké kanggo njaga stabilitasé bakal mundhak dadi 1,5.[40]
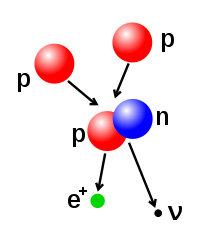
Gunggung proton lan neutron ing inti atom bisa diowahi, sanajan iki merlokaké ènèrgi kang dhuwur banget amarga gaya atraksiné kang kuwat. Fusi nuklir dumadi nalika akèh partikel atom padha nggabung minangka inti kang luwih abot. Minangka conto, ing inti Srengéngé, proton merlokaké ènèrgi watara 3–10 keV kanggo ngatasi gaya silih tulak antar pepadhané lan nggabung dadi sakinti.[41] Fisi nuklir wujud walikan saka prosès fusi. Ing fisi nuklir, inti dipecah dadi rong inti kang luwih cilik. Iki lumrahé dumadi lumantar paluruhan radhioaktif. Inti atom uga bisa diowahi lumantar panémbakan partikel subatom kanthi ènèrgi dhuwur. Yèn iki ngowahi gunggung proton sajeroning inti, atom mau bakal malih unsuré.[42][43]
Yèn massa inti sawisé dumadiné réaksi fusi luwih cilik tinimbang gunggung massa partikel awal panyusuné, mula prabédan iki disebabaké déning pangeculan pancaran ènèrgi (umpamané sinar gamma), kaya déné kang tinemu ing rumus kasetaran massa-ènèrgi Einstein, E = mc2, kanthi m iku massa kang ilang lan c iku karikatan cahya. Dhéfisit iki wujud péranganing ènèrgi pangiketan inti kang anyar.[44]
Fusi rong inti kang ngasilaké inti kang luwih gedhé kanthi nomer atom luwih cendhèk tinimbang wesi lan nikel (gunggung total nukleon padha karo 60) lumrahé asifat èksotèrmik, kang tegesé yèn prosès iki ngeculaké ènèrgi.[45] Prosès pangeculan ènèrgi iki kang agawé fusi nuklir ing lintang bisa dipertahanaké. Kanggo inti kang luwih abot, ènèrgi pangiketan per nukleon sajeroning inti wiwit tansaya medhun. Iki ateges yèn prosès fusi bakal asifat èndotèrmik.[40]
Méga èlèktron
[besut | besut sumber]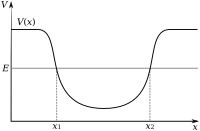
Èlèktron sajeroning siji atom ditarik déning proton sajeroning inti atom lumantar gaya èlèktromagnètik. Gaya iki ngiket èlèktron sajeroning sumur potènsi èlèktrostatik ing saubengé inti. Iki duwé teges yèn ènèrgi njaba diperlokaké supaya èlèktron bisa lolos saka atom. Saya cerak siji èlèktron menyang njero inti, saya gedhé gaya atraksiné, saéngga èlèktron kang ana cerak karo punjer sumur potènsi mbutuhaké ènèrgi kang luwih gedhé kanggo lolos.
Èlèktron, padha karo partikel liyané, duwé sipat kaya déné partikel uga kaya déné gelombang (dualisme gelombang-partikel). Méga èlèktron iku siji tlatah sajeroning sumur potènsi ing ngendi saben èlèktron ngasilaké sajinis gelombang meneng (ya iku gelombang kang ora obah rélatif marang inti) telung dhimènsi. Prilaku iki ditemtokaké déning orbital atom, ya iku siji fungsi matématika kang ngétung probabilitas siji èlèktron bakal mijil ing siji lokasi tinentu nalika posisiné diukur.[46] Mung bakal ana siji hmpunan orbital tinentu kang ana ing saubengé inti, amarga pola-pola gelombang liyané bakal kanthi rikat ngluruh dadi wangun kang luwih stabil.[47]

Saben orbital atom siluh korèspondhèn marang aras ènèrgi èlèktron tinentu. Èlèktron bisa malih kahanané menyang aras ènèrgi kang luwih dhuwur kanthi nyerep siji foton. Saliyané bisa munggah nuju aras ènèrgi kang luwih dhuwur, siji èlèktron bisa uga medhun menyang kaanan ènèrgi kang luwih cendhèk kanthi mancaraké ènèrgi kang turah minangka foton.[47]
Ènèrgi kang diperlokaké kanggo ngeculaké utawa uga nambah siji èlèktron (ènèrgi pangiketan èlèktron) iku luwih cilik tinimbang ènèrgi pangiketan nukleon. Minangka contoné, mung diperlokaké 13,6 eV kanggo ngeculaké èlèktron saka atom hidrogen.[48] Bandhingna karo ènèrgi kang gedhéné 2,3 MeV kang diperlokaké kanggo mecah inti deuterium.[49] Atom kanthi momotan listrik nétral amarga gunggung proton lan èlèktroné kang padha. Atom kang kakurangan utawa uga kaluwihan èlèktron ingaran minangka ion. Èlèktron kang ana ing paling njaba saka inti bisa ditransfer utawa uga dibagi menyang atom paling cerak liyané. Kanthi cara iki, atom bisa silih karoncé minangka molekul.[50]
Sifat-sipat
[besut | besut sumber]Sifat-sipat nuklir
[besut | besut sumber]Adhedhasar dhéfinisi, rong atom kanthi gunggung proton kang idhentik ing intiné kalebu sajeroning unsur kimia kang padha. Atom kanthi gunggung proton padha nanging kanthi gunggung neutron béda iku loro isotop béda saka siji unsur kang padha. Minangka contoné, kabèh hidrogen duwé proton siji, nanging ana siji isotop hidrogen kang ora duwé neutron (hidrogen-1), siji isotop kang duwé siji neutron (deuterium), loro neutron (tritium), lsp. Hidrogen-1 iku wangun isotop hidrogen kang paling umum. Sok-sok dhèwèké diarani protium.[51] Kabèh isotop unsur kang duwé nomer atom luwih gedhé saka 82 asifat radhioaktif.[52][53]
Saka watara 339 nuklida kang kawangun kanthi alami ing Bumi, 269 ing antarané durung tau kadeleng ngluruh.[54] Ing unsur kimia, 80 saka unsur kang dikawruhi duwé siji utawa luwih isotop stabil. Unsur 43, 63, lan kabèh unsur luwih dhuwur saka 83 ora duwé isotop stabil. Pitulikur unsur mung duwé siji isotop stabil, nalika gunggung isotop stabil kang paling akèh kadeleng ing unsur timah kanthi 10 jinis isotop stabil.[55]
Massa
[besut | besut sumber]Amarga mayoritas massa atom asalé saka proton dan neutron, gunggung sakabèhé partikel iki sajeroning atom diarani nomer massa. Massa atom ing kaanan meneng asring dièksprèsikaké migunakaké ékan massa atom (u) kang uga diarani dalton (Da). Ékan iki didhéfinisikaké minangka saprarolas massa atom karbon-12 nétral, kang kira-kira gedhéné 1,66 × 10−27 kg.[56] Hidrogen-1 kang wujud isotop paling ènthèng hidrogen duwé bobot atom 1,007825 u.[57] Atom duwé massa kang kira-kira padha karo nomer massané dipingké ékan massa atom.[58] Atom stabil kang paling abot ya iku timbal-208,[52] kanthi massa 207,9766521 u.[59]
Para kimiawan lumrahé migunakaké ékan mol kanggo nyatakaké gunggung atom. Sak mol didhéfinisikaké minangka gunggung atom kang ana ing 12 gram persis karbon-12. Gunggung iki ya iku watara 6,022 × 1023, kang ditepungi uga kanthi jeneng tetapan Avogadro. Kanthi mangkono siji unsur kanthi massa atom 1 u bakal duwé sak mol atom kang massané 0,001 kg. Minangka conto, Karbon duwé massa atom 12 u, saéngga sak mol karbon atom duwé massa 0,012 kg.[56]
Ukuran
[besut | besut sumber]Atom ora duwé watesan njaba kang cetha, saéngga dhimènsi atom lumrahé didhèskripsikaké minangka let antarané loro inti atom nalika loro atom silih gabung bebarengan sajeroning Roncèn kimia. Driji-driji iki manéka variasi gumantung marang jinis atom, jinis roncèn kang kalibat, gunggung atom ing saubengé, lan spin atom.[60] Ing tabèl périodhik unsur-unsur, driji-driji atom bakal cenderung mundhak sairing karo ningkaté périodhe (ndhuwur medhun). Suwaliké driji-driji atom bakal cenderung mundhak sairing karo medhuné nomer golongan (tengen mangiwa).[61] Mula, atom kang paling cilik iku hélium kanthi driji-driji 32 pm, nalika kang gedhé dhéwé iku sésium kanthi driji-driji 225 pm.[62] Dhimènsi iki maèwu-èwu luwih cilik saka gelombang cahya (400–700 nm), saéngga atom ora bisa dideleng migunakaké mikroskop optik biyasa. Nanging, atom bisa dideleng migunakaké mikroskop gaya atom.
Ukuran atom cilik banget, semono ciliké amba sak lèr rambut bisa nampung watara 1 yuta atom karbon.[63] Saktètès banyu uga ngandhut watara 2 × 1021 atom oksigèn.[64] Intan sak karat kanthi massa 2 × 10-4 kg ngandhut watara 1022 atom karbon.[catatan 1] Yèn siji apel digedhèkaké nganti saukuran gedhéné Bumi, mula atom sajeroning apel mau bakal katon gedhéné padha ukuran apel awal mau.[65]
Paluruhan radhioaktif
[besut | besut sumber]
Saben unsur duwé siji utawa luwih isotop kanthi inti ora stabil kang bakal ngalami paluruhan radhioaktif, njalari inti ngeculaké partikel utawa uga radhiasi èlèktromagnètik. Radhioaktivitas bisa dumadi nalika driji-driji inti gedhé banget dibandhingaké karo driji-driji gaya kuwat (mung dumadi ing let watara 1 fm).[66]
Wangun-wangun paluruhan radhioaktif kang paling umum ya iku:[67][68]
- Paluruhan alfa, dumadi nalika siji inti mancaraké partikel alfa (inti hélium kang kapérang saka rong proton lan rong neutron). Asil peluruhan iki wujud unsur anyar kanthi nomer atom kang luwih cilik.
- Paluruhan beta, diatur déning gaya lemah, lan diasilaké déning transformasi neutron dadi proton, uawa uga proton dadi neutron. Transformasi neutron dadi proton bakal ditutaké déning èmisi siji èlèktron lan siji antineutrino, nalika transformasi proton dadi neutron ditutaké déning èmisi siji positron lan siji neutrino. Èmisi èlèktron utawa uga èmisi positron ingaran minangka partikel beta. Paluruhan beta bisa ngundhakaké uga ngedhunaké nomer atom inti gunggungé siji.
- Paluruhan gama, diasilaké déning owah-owahan ing aras ènèrgi inti menyang kaanan kang luwih cendhak, njalari èmisi radhiasi èlèktromagnètik. Iki bisa dumadi sawisé èmisi partikel alfa utawa uga beta saka paluruhan radhioaktif.
Jinis-jinis paluruhan radhioaktif liyané kang luwih arang ngambah pangeculan neutron lan proton saka inti, èmisi punjul siji partikel beta, utawa uga paluruhan kang ngakibataké prodhuksi èlèktron kanthi karikatan dhuwur kang dudu sinar beta, lan prodhuksi foton kanthi ènèrgi dhuwur kang dudu sinar gama
Saben isotop radhioaktif duwé karakteristik périodhe wektu paluruhan (wektu paro) kang wujud suwéné wektu kang diperlokaké déning setengah gunggung sampel kanggo ngluruh entèk. Prosès paluruhan asifat èksponènsial, saéngga sawisé loro wektu paro, mung bakal kasisa 25% isotop.[66]
Momèn magnètik
[besut | besut sumber]Saben partikel èlemèntèr duwé sipat mékanika kuantum intrinsik kang ditepungi kanthi jeneng spin. Spin duwé analogi karo momèntum pojok siji objèk kang mubeng ing punjer massané, sanajan kanthi kaku partikel ora duwé prilaku kaya mangkéné iki. Spin diukur sajeroning ékan tetapan Planck karédhuksi (ħ), kanthi èlèktron, proton, lan neutron sakabèhé duwé spin ½ ħ, utawa "spin-½". Sajeroning atom, èlèktron kang obah ing saubengé inti atom saliyané duwé spin uga duwé momèntum pojok orbital, nalika inti atom duwé momèntum pojok uga amarga spin nukliré dhéwé.[69]
Médhan magnèt kang diasilaké déning siji atom (ingaran momèn magnètik) ditemtokaké déning kombinasi manéka jinis momèntum pojok iki. Nanging, kontribusi kang gedhé dhéwé tetep asalé saka spin. Amarga èlèktron manut asas pengecualian Pauli, yiku ora ana loro èlèktron kang bisa tinemu ing kaanan kuantum kang padha, pasangan èlèktron kang karoncé siji lan sijiné duwé spin kang lelawanan, kanthi siji mawa spin munggah, lan kang sijiné manèh mawa spin mudhun. Kaloro spin kang lelawanan iki bakal silih nétralaké, saéngga momèn dipol magnètik totalé dadi nol ing sapérangan atom kanthi gunggung èlèktron genep.[70]
Ing atom kanthi èlèktron ganjil kaya déné wesi, anané èlèktron kang ora duwé pasangan njalari atom mau asifat féromagnètik. Orbital-orbital atom ing saubengé atom mau silih tumpang tindhih lan pamudhunan kaanan ènèrgi digayuh nalika spin èlèktron kang ora duwé pasangan kasusun silih sajajar. Prosès iki ingaran minangka interaksi ijolan. Nalika momèn magnètik atom féromagnètik kasusun silih sajajar, bahan kang kasusun déning atom iki bisa ngasilaké médhan makroskopis kang bisa didhetèksi. Bahan-bahan kang asifat paramagnètik duwé atom kanthi momèn magnètik kang kasusun acak, saéngga ora ana médhan magnèt kang diasilaké. Nanging, momèn magnètik saben atom indhividu mau bakal kasusun silih sajajar nalika diwènèhi médhan magnèt.[70][71]
Inti atom uga bisa duwé spin. Lumrahé spin inti kasusun kanthi acak amarga kasetimbangan tèrmal. Nanging, kanggo unsur-unsur tinentu (kaya déné xenon-129), iku mungkin kanggo molarisasi kaanan spin nuklir kanthi signifikan saéngga spin-spin mau kasusun silih sajajar kanthi arah kang padha. Kondhisi iki ingaran minangka hiperpolarisasi. Fénoména iki duwé aplikasi kang wigati sajeroning pancitraan résonansi magnètik.[72][73]
Aras-aras ènèrgi
[besut | besut sumber]Nalika siji èlèktron karoncé ing siji atom, dhèwèké duwé ènèrgi potènsial kang bebandhing kuwalik marang let èlèktron marang inti. Iki diukur déning gedhéné ènèrgi kang diperlokaké kanggo ngeculaké èlèktron saka atom lan lumrahé dièksprèsikaké kanthi satuwan èlèktronvolt (eV). Sajeroning modhèl mékanika kuantum, èlèktron-èlèktron kang karoncé mung bisa nglungguhi sak sèt kaanan kang punjeré ing inti, lan saben kaanan silih korèspondhènsi marang aras ènèrgi tinentu. Kaanan ènèrgi paling asor siji èlèktron kang karoncé ingaran minangka kaanan dhasar, nalika kaanan ènèrgi kang luwih dhuwur ingaran minangka kaanan kaèksitasi.[74]
Supaya siji èlèktron bisa mlumpat saka siji kaanan menyang kaanan liyané, dhèwèké kudu nyerep utawa mancaraké foton ing ènèrgi kang selaras karo prabédan ènèrgi potènsial antar rong aras mau. Ènèrgi foton kang dipancaraké iku sebandhing karo frékuènsiné.[75] Saben unsur duwé spèktrum karakteristiké dhéwé-dhéwé. Iki gumantung marang momotan inti, subklopak kang kaisi karo èlèktron, interaksi èlèktromagnètik antar èlèktron, lan faktor-faktor liyané.[76]

Nalika siji spèktrum ènèrgi kang sambung terus dipancaraké liwat siji gas utawa uga plasma, sapérangan foton diserep déning atom, njalari èlèktron pindhah aras ènèrgi. Èlèktron kang kaèksitasi bakal kanthi spontan mancaraké ènèrgi iki minangka foton lan tiba manèh menyang aras ènèrgi kang luwih cendhèk. Mula saka iku, atom duwé prilaku kaya déné bahan panyaring kang bakal minangka sadhèrètan pita absorpsi. Pangukuran spèktroskopi marang kekuwatan lan amba pita spèktrum ngidinaké panemton komposisi lan sipat-sipat fisika siji dat.[77]
Pangamatan cermat ing garis-garis spèktrum nuduhaké yèn sapérangan ngétokaké anané pamisahan alus. Iki dumadi amarga kopling spin-orbit kang wujud interaksi antarané spin karo obahing èlèktron paling njaba.[78] Nalika siji atom ana sajeroning médhan magnèt èksternal, garis-garis spèktrum kapisah dadi telu komponèn utawa luwih. Iki ingaran minangka èfèk Zeeman. Èfèk Zeeman disebabaké déning interaksi médhan magnèt karo momèn magnètik atom lan èlèktroné. Sapérangan atom bisa duwé akèh konfigurasi èlèktron kanthi aras ènèrgi kang padha, saéngga bakal katon minangka siji garis spèktrum. Interaksi médhan magnèt karo atom bakal nggèsèr konfigurasi-konfigurasi èlèktron nuju aras ènèrgi kang béda sithik, njalari garis spèktrum dhobel.[79] Anané médhan listrik èksternal bisa njalari pamisahan lan panggèsèran garis spèktrum kanthi ngowahi aras ènèrgi èlèktron. Fénoména iki ingaran minangka èfèk Stark.[80]
Valènsi lan prilaku roncèn
[besut | besut sumber]Klopak utawa kulit èlèktron paling njaba siji atom sajeroning kaanan kang ora kakombinasi diarani klopak valènsi lan èlèktron sajeroning klopak mau diarani èlèktron valènsi. Gunggung èlèktron valènsi nemtokaké prilaku roncèn atom mau karo atom liyané. Atom cenderung réaksi karo siji lan sijiné lumantar pangisian (utawa uga pangosongan) èlèktron valènsi paling njaba atom.[81] Roncèn kimia bisa dideleng minangka transfer èlèktron saka siji atom menyang atom liyané, kaya déné kang kadeleng ing natriyum klorida lan garam-garam ionik liyané. Nanging, akèh uga unsur kang nuduhaké prilaku valènsi gandha, utawa kacendrungan mbagi èlèktron kanthi gunggung kang béda ing senyawa kang béda. Saéngga, roncèn kimia antarané unsur-unsur iki cenderung wujud pambagéyan èlèktron tinimbang transfer èlèktron. Contoné ngambah unsur karbon sajeroning senyawa organik.[82]
Unsur-unsur kimia asring ditampilaké sajeroning tabèl pèriodhik kang nampilaké sipat-sipat kimia siji unsur kang duwé pola. Unsur-unsur kanthi gunggung èlèktron valènsi kang padha diklompokaké kanthi vèrtikel (ingaran golongan). Unsur-unsur ing pérangan paling tengen tabèl duwé klopak paling nabané kaisi kebak, njalari unsur-unsur mau cenderung asifat inert (gas mulia).[83][84]
Kaanan
[besut | besut sumber]
Sapérangan atom tinemu sajeroning kaanan matèri kang béda-béda gumantung ing kondhisi fisik bandha, ya iku suhu lan tekanan. Kanthi ngowahi kondhisi mau, matèri bisa molah-malih dadi wangun padhet, cuwèr, gas, lan plasma.[85] Sajeroning saben kaanan mau uga matèri bisa duwé manéka fase. Minangka contoné ing karbon padhet, dhèwèké bisa wujud grafit uga inten.[86]
Ing suhu nyeraki nol mutlak, atom bisa minangka kondhènsat Bose-Einstein, ing endi èfèk-èfèk mékanika kuantum kang lumrahé mung kadeleng ing skala atom kadeleng kanthi makroskopis.[87][88] Kumpulan atom-atom kang diliwat-adhemké iki duwé prilaku kaya déné siji atom super.[89]
Idhèntifikasi
[besut | besut sumber]
Mikroskop panrowongan payaran (scanning tunneling microscope) iku siji mikroskop kang dipigunakaké kanggo ndeleng lumahing siji bandha ing tingkat atom. Piranti iki migunakaké fénoména panrowongan kuantum kang ngidinaké partikel-partikel nembus sawar kang lumrahé ora bisa diliwati.
Sawijining atom bisa diionisasi kanthi nguwalaké siji èlèktroné. Muatan kang ana njalari trayèktori atom mlengkung nalika dhèwèké ngliwati siji médhan magnèt. Driji-driji trayèktori ion mau ditemtokaké déning massa atom. Spèktromèter massa migunakaké prinsip iki kanggo ngétung rasio massa marang momotan ion. Yèn sampel mau ngandhut sapérangan isotop, spèktromèter massa bisa nemtokaké proporsi saben isotop kanthi ngukur intènsitas berkas ion kang béda. Tèknik kanggo nguwapaké atom ngambah spèktroskopi émisi atomik plasma gandhèng indhuktif (inductively coupled plasma atomic emission spectroscopy) lan spèktromètri massa plasma gandhèng indhuktif (inductively coupled plasma mass spectrometry), kaloroné migunakaké plasma kanggo nguwapaké sampel analisis.[90]
Métodhe liyané kang luwih selèktif ya iku spèktroskopi panguwalan ènèrgi èlèktron (electron energy loss spectroscopy), kang ngukur panguwalan ènèrgi berkas èlèktron sajeroning siji mikroskop èlèktron transmisi nalika dhèwèké interaksi karo sampel. Tomografi kuar atom duwé résolusi sub-nanomèter sajeroning 3-D lan bisa kanthi kimiawi ngidhèntifikasi atom-atom indhividhu migunakaké spèktromètri massa wektu lintas.[91]
Spèktrum kaanan kaèksitasi bisa dipigunakaké kanggo nganalisa komposisi atom lintang kang adoh. Dawa gelombang cahya tinentu kang dipancaraké déning lintang bisa dipisahaké lan dicocokaké karo transisi kakuantisasi atom gas bébas. Werna lintang sabanjuré bisa diréplikasi migunakaké lampu lucutan gas kang ngandhung unsur kang padha.[92] Hèliyum ing Srengéngé tinemu kanthi migunakaké cara iki 23 taun sadurungé dhèwèké tinemu ing Bumi.[93]
Asal usul lan kaanan saiki
[besut | besut sumber]Atom nglungguhi watara 4% dhènsitas ènèrgi total kang ana sajeroning alam semesta kadeleng, kanthi dhènsitas rata-rata watara 0,25 atom/m3.[94] Sajeroning galaksi Bimasekti, atom nduwé konsèntrasi kang luwih dhuwur, kanthi dhènsitas matèri sajeroning médhium antarlintang kisarané watara 105 nganti tekan 109 atom/m3.[95] Srengéngé dhéwé dipercaya ana sajeroning Gelembung Lokal, ya iku siji tlatah kang ngandhut akèh gas ion, saéngga dhènsitas ing saubengé iku watara 103 atom/m3.[96] Lintang minangka méga-méga padhet sajeroning médhium antarlintang, lan prosès èvolusionèr lintang bakal njalari paningkatan kandhungan unsur kang luwih abot tinimbang hidrogen lan hélium sajeroning médhium antarlintang. Nganti tekan 95% atom Bimasekti kakonsèntrasi sajeroning lintang-lintang, lan massa total atom iki minangka watara 10% massa galaksi.[97] Massa sisané iku matèri peteng kang ora dikawruhi kanthi cetha.[98]
Nukleosintesis
[besut | besut sumber]Proton lan èlèktron kang stabil mijik sadhetik sawisé kadadéan Dhentuman Gedhé. Sajeroning mangsa wektu telung menit sawisé, nukleosintesis Dhentuman Gedhé akèh-akèhé ngasilaké hèliyum, litiyum, lan deuterium, lan mungkin uga sapérangan bèriliyum lan boron.[99][100][101] Atom pisanan (kanthi èlèktron kang katalènan karo dhèwèké) kanthi téoritis karipta 380.000 taun sawisé Dhentuman Gedhé, ya iku nalika alam semesta kang nrembaka cukup adhem kanggo ngidinaké èlèktron-èlèktron katalènan ing inti atom.[102] Wiwit wektu iku, inti atom wiwit nggabung sajeroning lintang-lintang lumantar prosès fusi nuklir lan ngasilaké unsur-unsur kang luwih abot nganti tekan wesi.[103]
Isotop kaya déné litium-6 diasilaké ing ruwang akasa lumantar spalasi sinar kosmis.[104] Iki dumadi nalika siji proton kanthi ènèrgi dhuwur numbuk inti atom, njalari sapérangan gedhé nukleon sumebar. Unsur kang luwih abot tinimbang wesi diasilaké ing supernova lumantar prosès r lan ing lintang-lintang AGB lumantar prosès s. Kaloroné nglibataké panyekelan neutron déning inti atom.[105] Unsur-unsur kaya déné timbal akèh-akèhé diwangun lumantar paluruhan radhioaktif unsur-unsur liya kang luwih abot.[106]
Bumi
[besut | besut sumber]Akèh-akèhé atom kang nyusun Bumi lan kalebu uga kabèh makluk uripé tau ana sajeroning wangun kang saiki ing nébula kang runtuh saka awan molekul lan minangka Tata Surya. Sisané wujud akibat saka paluruhan radhioaktif lan proporsiné bisa kanggo nemtokaké umur Bumi lumantar pananggalan radhiomètrik.[107][108] Akèh-akèhé hélium sajeroning kerak Bumi wujud prodhuk paluruhan alfa.[109]
Ana saklumit atom ing Bumi kang ing awal pambentukané ora ana lan uga dudu wujud akibat saka paluruhan radhioaktif. Karbon-14 kanthi kasinambungan diasilaké déning sinar kosmik ing atmosfèr.[110] Sapérangan atom ing Bumi kanthi gawéan diasilaké déning réaktor utawa uga gegaman nuklir.[111][112] Saka kabèh Unsur-unsur transuranium kang nomer atomé luwih gedhé saka 92, mung plutonium lan neptunium waé kang ana ing Bumi kanthi alami.[113][114] Unsur-unsur transuranium duwé wektu paro radhioaktif kang luwih cendhak tinimbang umur Bumi[115], saéngga unsur-unsur iki wis suwé luruh. Kejaba ana ing plutonium-244 kang kamungkinan kasimpen sajeroning lebu kosmik.[107] Kandhungan alami plutonium lan neptunium diasilaké saka panyekelan neutron sajeroning bijih uranium.[116]
Bumi ngandhut watara 1,33 × 1050 atom.[117] Ing atmosfèr planit, ana sagunggung cilik atom gas mulia kaya déné argon lan neon. Sisa 99% atom ing atmosfèr bumi katalènan sajeroning wangun molekul, upamané karbon dioksida, oksigèn diatomik, lan nitrogen diatomik. Ing lumahing Bumi, atom-atom tetalènan minangka manéka jinis senyawa, ngambah banyu, garam, silikat, lan oksida. Atom uga bisa nggabung minangka bahan-bahan kang ora kapérang saka molekul, contohné kristal lan logam padhet utawa uga cuwèr.[118][119]
Wangun téoritis lan wangun langka
[besut | besut sumber]
Nalika isotop kanthi nomer atom kang luwih dhuwur tinimbang timbal (62) asifat radhioaktif, ana siji "pulo stabilitas" kang diajokaké kanggo sapérangan unsur kanthi nomer atom ing sandhuwuré 103. Unsur-unsur super abot iki kamungkinan duwé inti kang kanthi rélatif stabil marang paluruhan radhioaktif.[120] Atom super abot kang stabil iki kamungkinan gedhé iku unbiheksium, kanthi 126 proton 184 neutron.[121]
Saben partikel matèri duwé partikel antimatèriné dhéwé-dhéwé kanthi momotan listrik kang lelawanan. Saéngga, positron iku antièlèktron kang muatané positif, lan antiproton iku proton kang muatané négatif. Nalika matèri lan antimatèri ketemu, kaloroné bakal silih musnahaké. Ana kaoraseimbangan antarané gunggung partikel matèri lan antimatèri. Kaoraseimbangan iki isih durung dipahami kanthi nyluruh, sanajan ana téyori bariogenesis kang mènèhaké wedharan kang mungkinaké. Antimatèri ora tau tinemu kanthi alami.[122][123] Nanging, nalika taun 1996, antihidrogen kasil disintèsis ing laboratorium CERN ing Jenewa.[124][125]
Ana uga atom-atom langka liyané kang digawé kanthi nggantèkaké siji proton, neutron, utawa uga èlèktron karo partikel liya kang muatané padha. Minangka conto, èlèktron bisa digantèkaké karo muon kang luwih abot, minangka atom muon. Jinis atom iki bisa kanggo nguji prédhiksi fisika.[126][127][128]
Delengan uga
[besut | besut sumber]Cathetan
[besut | besut sumber]- ↑ Sak karat padha karo 200 miligram. Adhedhasar dhéfinisi, karbon-12 duwé 0,012 kg per mol. Tetapan Avogadro watara 6 × 1023 atom per mol.
Réferènsi
[besut | besut sumber]- ↑ a b c d e f g Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- ↑ a b c d e f Haubold, Hans; Mathai, A. M. (1998). "Microcosmos: From Leucippus to Yukawa". Structure of the Universe. Common Sense Science. Diarsip saka sing asli ing 2008-10-01. Dibukak ing 2008-01-17.
- ↑ a b Ponomarev (1993:14-15).
- ↑ a b A. Pablo Iannone. Dictionary of World Philosophy. kc. 62. ISBN 0-415-17995-5. Dibukak ing 2010-06-09.
- ↑ Hajime Nakamura (1992). A comparative history of ideas. Shri Jainendra Press. kc. 145. ISBN 9788120810044. Dibukak ing 2010-06-09.
- ↑ Ben-Ami Scharfstein (1998). A comparative history of world philosophy: from the Upanishads to Kant. State University of New York Press. kc. 189. ISBN 0-7914-3683-7. Dibukak ing 2010-06-09.
- ↑ Siegfried (2002:42–55).
- ↑ "Lavoisier's Elements of Chemistry". Elements and Atoms. Le Moyne College, Department of Chemistry. Dibukak ing 2007-12-18.
- ↑ Wurtz (1881:1–2).
- ↑ Dalton (1808).
- ↑ Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). Annalen der Physik . 322 (8): 549–560. doi:10.1002/andp.19053220806. Diarsip saka sing asli (PDF) ing 2006-03-18. Dibukak ing 2007-02-04.
- ↑ Mazo (2002:1–7).
- ↑ Lee, Y. K.; Hoon, Kelvin (1995). "Brownian Motion". Imperial College, London. Diarsip saka sing asli ing 2007-12-18. Dibukak ing 2007-12-18.
- ↑ Patterson, Gary (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003. Dibukak ing 2008-11-07.
- ↑ The Nobel Foundation (1906). "J.J. Thomson". Nobelprize.org. Dibukak ing 2007-12-20.
- ↑ "Frederick Soddy, The Nobel Prize in Chemistry 1921". Nobel Foundation. Dibukak ing 2008-01-18.
- ↑ Thomson, Joseph John (1913). "Rays of positive electricity". Proceedings of the Royal Society. A 89: 1–20. Dibukak ing 2007-01-18.
- ↑ Stern, David P. (May 16, 2005). "The Atomic Nucleus and Bohr's Early Modhèl of the Atom". NASA Goddard Space Flight Center. Diarsip saka sing asli ing 2007-08-20. Dibukak ing 2007-12-20.
- ↑ Bohr, Niels (December 11, 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". The Nobel Foundation. Dibukak ing 2008-02-16.
- ↑ Lewis, Gilbert N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002.
- ↑ Scerri, Eric R. (2007). The Periodic Table. Oxford University Press US. kc. 205–226. ISBN 0195305736.
- ↑ Scully, Marlan O.; Lamb Jr., Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics. 17 (6): 575–583. doi:10.1007/BF01882788.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. Dibukak ing 2007-12-21.
- ↑ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto. Dibukak ing 2007-12-21.
- ↑ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine. 39 (6): 449–55.
- ↑ Chadwick, James (December 12, 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation. Dibukak ing 2007-12-21.
- ↑ Kullander, Sven (August 28, 2001). "Accelerators and Nobel Laureates". The Nobel Foundation. Dibukak ing 2008-01-31.
- ↑ Staff (October 17, 1990). "The Nobel Prize in Physics 1990". The Nobel Foundation. Dibukak ing 2008-01-31.
- ↑ Staff (October 15, 1997). "The Nobel Prize in Physics 1997". Nobel Foundation. Dibukak ing 2008-02-10.
- ↑ Park, Jiwoong; et al. (2002). "Coulomb blockade and the Kondo effect in single-atom transistors". Nature. 417 (6890): 722–25. doi:10.1038/nature00791. Dibukak ing 2008-01-03.
- ↑ Domokos, P.; Janszky, J.; Adam, P. (1994). "Single-atom interference method for generating Fock states". Physical Review a. 50: 3340–44. doi:10.1103/PhysRevA.50.3340. Dibukak ing 2008-01-03.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Demtröder (2002:39–42).
- ↑ Woan (2000:8).
- ↑ Particle Data Group (2002). "The Particle Adventure". Lawrence Berkeley Laboratory. Dibukak ing 2007-01-03.
- ↑ Schombert, James (April 18, 2006). "Elementary Particles". University of Oregon. Diarsip saka sing asli ing 2011-08-30. Dibukak ing 2007-01-03.
- ↑ Basic Knowledge of Radiation and Radioisotopes (Scientific Basis, Safe Handling of Radioisotopes and Radiation Protection). Japan Radioisotope Association. 2005. ISBN 4-89073-170-9 C2040.
- ↑ Jevremovic (2005:63).
- ↑ Pfeffer (2000:330–336).
- ↑ Wenner, Jennifer M. (October 10, 2007). "How Does Radioactive Decay Work?". Carleton College. Dibukak ing 2008-01-09.
- ↑ a b c Raymond, David (April 7, 2006). "Nuclear Binding Energies". New Mexico Tech. Diarsip saka sing asli ing 2002-12-01. Dibukak ing 2007-01-03.
- ↑ Mihos, Chris (July 23, 2002). "Overcoming the Coulomb Barrier". Case Western Reserve University. Dibukak ing 2008-02-13.
- ↑ Staff (March 30, 2007). "ABC's of Nuclear Science". Lawrence Berkeley National Laboratory. Diarsip saka sing asli ing 2006-12-05. Dibukak ing 2007-01-03.
- ↑ Makhijani, Arjun; Saleska, Scott (March 2, 2001). "Basics of Nuclear Physics and Fission". Institute for Energy and Environmental Research. Dibukak ing 2007-01-03.
- ↑ Shultis et al. (2002:72–6).
- ↑ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics. 63 (7): 653–58. doi:10.1119/1.17828. Dibukak ing 2007-02-01.
- ↑ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science. 157 (3784): 13–24. doi:10.1126/science.157.3784.13. PMID 5338306.
- ↑ a b Brucat, Philip J. (2008). "The Quantum Atom". University of Florida. Diarsip saka sing asli ing 2006-12-07. Dibukak ing 2007-01-04.
- ↑ Herter, Terry (2006). "Lecture 8: The Hydrogen Atom". Cornell University. Dibukak ing 2008-02-14.
- ↑ Bell, R. E.; Elliott, L. G. (1950). "Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron". Physical Review. 79 (2): 282–285. doi:10.1103/PhysRev.79.282.
- ↑ Smirnov (2003:249–72).
- ↑ Matis, Howard S. (August 9, 2000). "The Isotopes of Hydrogen". Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. Diarsip saka sing asli ing 2007-12-18. Dibukak ing 2007-12-21.
- ↑ a b Sills (2003:131–134).
- ↑ Dumé, Belle (April 23, 2003). "Bismuth breaks half-life record for alpha decay". Physics World. Dibukak ing 2007-12-21.
- ↑ Lindsay, Don (July 30, 2000). "Radioactives Missing From The Earth". Don Lindsay Archive. Dibukak ing 2007-05-23.[pranala mati permanèn]
- ↑ CRC Handbook (2002).
- ↑ a b Mills et al. (1993).
- ↑ Chieh, Chung (January 22, 2001). "Nuclide Stability". University of Waterloo. Diarsip saka sing asli ing 2007-08-30. Dibukak ing 2007-01-04.
- ↑ "Atomic Weights and Isotopic Compositions for All Elements". National Institute of Standards and Technology. Dibukak ing 2007-01-04.
- ↑ Audi, G.; Wapstra, A. H.; Thibault C. (2003). "The Ame2003 atomic mass evaluation (II)". Nuclear Physics A. 729: 337–676. doi:10.1016/j.nuclphysa.2003.11.003. Diarsip saka sing asli ing 2008-09-16. Dibukak ing 2008-02-07.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica, Section a. 32: 751. doi:10.1107/S0567739476001551. Dibukak ing 2007-01-03.
- ↑ Dong, Judy (1998). "Diameter of an Atom". The Physics Factbook. Diarsip saka sing asli ing 2007-11-04. Dibukak ing 2007-11-19.
- ↑ Zumdahl (2002).
- ↑ Staff (2007). "Small Miracles: Harnessing nanotechnology". Oregon State University. Dibukak ing 2007-01-07.—describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ↑ Padilla et al. (2002:32)—"There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ↑ Feynman (1995).
- ↑ a b "Radioactivity". Splung.com. Dibukak ing 2007-12-19.
- ↑ L'Annunziata (2003:3–56).
- ↑ Firestone, Richard B. (May 22, 2000). "Radioactive Decay Modes". Berkeley Laboratory. Diarsip saka sing asli ing 2006-09-29. Dibukak ing 2007-01-07.
- ↑ Hornak, J. P. (2006). "Chapter 3: Spin Physics". The Basics of NMR. Rochester Institute of Technology. Dibukak ing 2007-01-07.
- ↑ a b Schroeder, Paul A. (February 25, 2000). "Magnetic Properties". University of Georgia. Diarsip saka sing asli ing 2007-04-29. Dibukak ing 2007-01-07.
- ↑ Goebel, Greg (September 1, 2007). "[4.3] Magnetic Properties of the Atom". Elementary Quantum Physics. In The Public Domain website. Dibukak ing 2007-01-07.
- ↑ Yarris, Lynn (Spring 1997). "Talking Pictures". Berkeley Lab Research Review. Diarsip saka sing asli ing 2008-01-13. Dibukak ing 2008-01-09.
- ↑ Liang and Haacke (1999:412–26).
- ↑ Zeghbroeck, Bart J. Van (1998). "Energy levels". Shippensburg University. Diarsip saka sing asli ing 2005-01-15. Dibukak ing 2007-12-23.
- ↑ Fowles (1989:227–233).
- ↑ Martin, W. C.; Wiese, W. L. (2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology. Dibukak ing 2007-01-08.
- ↑ "Atomic Emission Spectra — Origin of Spectral Lines". Avogadro Web Site. Diarsip saka sing asli ing 2006-02-28. Dibukak ing 2006-08-10.
- ↑ Fitzpatrick, Richard (February 16, 2007). "Fine structure". University of Texas at Austin. Dibukak ing 2008-02-14.
- ↑ Weiss, Michael (2001). "The Zeeman Effect". University of California-Riverside. Dibukak ing 2008-02-06.
- ↑ Beyer (2003:232–236).
- ↑ Reusch, William (July 16, 2007). "Virtual Textbook of Organic Chemistry". Michigan State University. Dibukak ing 2008-01-11.
- ↑ "Covalent bonding-Single bonds". chemguide. 2000.
- ↑ Husted, Robert; et al. (December 11, 2003). "Periodic Table of the Elements". Los Alamos National Laboratory. Dibukak ing 2008-01-11.
- ↑ Baum, Rudy (2003). "It's Elemental: The Periodic Table". Chemical & Engineering News. Dibukak ing 2008-01-11.
- ↑ Goodstein (2002:436–438).
- ↑ Brazhkin, Vadim V. (2006). "Metastable phases, phase transformations, and phase diagrams in physics and chemistry". Physics-Uspekhi. 49: 719–24. doi:10.1070/PU2006v049n07ABEH006013.
- ↑ Myers (2003:85).
- ↑ Staff (October 9, 2001). "Bose-Einstein Condensate: A New Form of Matter". National Institute of Standards and Technology. Diarsip saka sing asli ing 2008-01-03. Dibukak ing 2008-01-16.
- ↑ Colton, Imogen; Fyffe, Jeanette (February 3, 1999). "Super Atoms from Bose-Einstein Condensation". The University of Melbourne. Diarsip saka sing asli ing 2007-08-29. Dibukak ing 2008-02-06.
- ↑ Jakubowski, N.; Moens, L.; Vanhaecke, F (1998). "Sector field mass spectrometers in ICP-MS". Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–63. doi:10.1016/S0584-8547(98)00222-5.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). "The Atom-Probe Field Ion Microscope". Review of Scientific Instruments. 39 (1): 83–86. doi:10.1063/1.1683116. ISSN 0034-6748.
- ↑ Lochner, Jim; Gibb, Meredith; Newman, Phil (April 30, 2007). "What Do Spectra Tell Us?". NASA/Goddard Space Flight Center. Dibukak ing 2008-01-03.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ↑ Winter, Mark (2007). "Helium". WebElements. Dibukak ing 2008-01-03.
- ↑ Hinshaw, Gary (February 10, 2006). "What is the Universe Made Of?". NASA/WMAP. Dibukak ing 2008-01-07.
- ↑ Choppin et al. (2001).
- ↑ Davidsen, Arthur F. (1993). "Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission". Science. 259 (5093): 327–34. doi:10.1126/science.259.5093.327. PMID 17832344. Dibukak ing 2008-01-07.
- ↑ Lequeux (2005:4).
- ↑ Smith, Nigel (January 6, 2000). "The search for dark matter". Physics World. Dibukak ing 2008-02-14.
- ↑ Croswell, Ken (1991). "Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium". New Scientist (1794): 42. Dibukak ing 2008-01-14.
- ↑ Copi, Craig J.; Schramm, David N.; Turner, Michael S. (1995). "Big-Bang Nucleosynthesis and the Baryon Density of the Universe" (PDF). Science. 267: 192–99. doi:10.1126/science.7809624. PMID 7809624. Dibukak ing 2008-01-13.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Hinshaw, Gary (December 15, 2005). "Tests of the Big Bang: The Light Elements". NASA/WMAP. Dibukak ing 2008-01-13.
- ↑ Abbott, Brian (May 30, 2007). "Microwave (WMAP) All-Sky Survey". Hayden Planetarium. Dibukak ing 2008-01-13.
- ↑ F. Hoyle (1946). "The synthesis of the elements from hydrogen". Monthly Notices of the Royal Astronomical Society. 106: 343–83. Dibukak ing 2008-01-13.
- ↑ Knauth, D. C.; Federman, S. R.; Lambert, David L.; Crane, P. (2000). "Newly synthesized lithium in the interstellar medium". Nature. 405: 656–58. doi:10.1038/35015028.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Mashnik, Stepan G. (2000). "On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes". Cornell University. Dibukak ing 2008-01-14.
- ↑ Kansas Geological Survey (May 4, 2005). "Age of the Earth". University of Kansas. Diarsip saka sing asli ing 2008-07-05. Dibukak ing 2008-01-14.
- ↑ a b Manuel (2001:407–430,511–519).
- ↑ Dalrymple, G. Brent (2001). "The age of the Earth in the twentieth century: a problem (mostly) solved". Geological Society, London, Special Publications. 190: 205–21. doi:10.1144/GSL.SP.2001.190.01.14. Dibukak ing 2008-01-14.
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders (September 2, 2006). "Helium: Fundamental models". MantlePlumes.org. Dibukak ing 2007-01-14.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ↑ Pennicott, Katie (May 10, 2001). "Carbon clock could show the wrong time". PhysicsWeb. Dibukak ing 2008-01-14.
- ↑ Yarris, Lynn (July 27, 2001). "New Superheavy Elements 118 and 116 Discovered at Berkeley Lab". Berkeley Lab. Dibukak ing 2008-01-14.
- ↑ Diamond, H.; et al. (1960). "Heavy Isotope Abundances in Mike Thermonuclear Device" (subscription required). Physical Review. 119: 2000–04. doi:10.1103/PhysRev.119.2000. Dibukak ing 2008-01-14.
- ↑ Poston Sr., John W. (March 23, 1998). "Do transuranic elements such as plutonium ever occur naturally?". Scientific American. Dibukak ing 2008-01-15.
- ↑ Keller, C. (1973). "Natural occurrence of lanthanides, actinides, and superheavy elements". Chemiker Zeitung. 97 (10): 522–30. Dibukak ing 2008-01-15.
- ↑ Marco (2001:17).
- ↑ "Oklo Fossil Reactors". Curtin University of Technology. Diarsip saka sing asli ing 2007-12-18. Dibukak ing 2008-01-15.
- ↑ Weisenberger, Drew. "How many atoms are there in the world?". Jefferson Lab. Dibukak ing 2008-01-16.
- ↑ Pidwirny, Michael. "Fundamentals of Physical Geography". University of British Columbia Okanagan. Dibukak ing 2008-01-16.
- ↑ Anderson, Don L. (2002). "The inner inner core of Earth". Proceedings of the National Academy of Sciences. 99 (22): 13966–68. doi:10.1073/pnas.232565899. PMID 12391308. Diarsip saka sing asli ing 2013-08-01. Dibukak ing 2008-01-16.
- ↑ Anonymous (October 2, 2001). "Second postcard from the island of stability". CERN Courier. Diarsip saka sing asli ing 2008-02-03. Dibukak ing 2008-01-14.
- ↑ Jacoby, Mitch (2006). "As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine". Chemical & Engineering News. 84 (10): 19. Dibukak ing 2008-01-14.
- ↑ Koppes, Steve (March 1, 1999). "Fermilab Physicists Find New Matter-Antimatter Asymmetry". University of Chicago. Dibukak ing 2008-01-14.
- ↑ Cromie, William J. (August 16, 2001). "A lifetime of trillionths of a second: Scientists explore antimatter". Harvard University Gazette. Dibukak ing 2008-01-14.
- ↑ Hijmans, Tom W. (2002). "Particle physics: Cold antihydrogen". Nature. 419: 439–40. doi:10.1038/419439a.
- ↑ Staff (October 30, 2002). "Researchers 'look inside' antimatter". BBC News. Dibukak ing 2008-01-14.
- ↑ Barrett, Roger; Jackson, Daphne; Mweene, Habatwa (1990). "The Strange World of the Exotic Atom". New Scientist (1728): 77–115. Diarsip saka sing asli ing 2007-12-21. Dibukak ing 2008-01-04.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Indelicato, Paul (2004). "Exotic Atoms". Physica Scripta. T112: 20–26. doi:10.1238/Physica.Topical.112a00020.
- ↑ Ripin, Barrett H. (1998). "Recent Experiments on Exotic Atoms". American Physical Society. Dibukak ing 2008-02-15.
Réferènsi buku
[besut | besut sumber]- L'Annunziata, Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. ISBN 0124366031. OCLC 162129551.
- Beyer, H. F.; Shevelko, V. P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. ISBN 0750304812. OCLC 47150433.
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. ISBN 0750674636. OCLC 162592180.
{{cite book}}: CS1 maint: multiple names: authors list (link) - Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic-Molecular-and Quantum Physics (édhisi ka-1st). Springer. ISBN 3540206310. OCLC 181435713.
- Feynman, Richard (1995). Six Easy Pieces. The Penguin Group. ISBN 978-0-140-27666-4. OCLC 40499574.
- Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. ISBN 0486659577. OCLC 18834711.
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Goodstein, David L. (2002). States of Matter. Courier Dover Publications. ISBN 0-486-49506-X.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0521773512. OCLC 50441595.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0415179955. OCLC 44541769.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. ISBN 0387232842. OCLC 228384008.
- Lequeux, James (2005). The Interstellar Medium. Springer. ISBN 3540213260. OCLC 133157789.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
- Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G. (èd.). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). Vol. 2. John Wiley & Sons. kc. 412–26. ISBN 0471139467. Dibukak ing 2008-01-09.
- MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 0195218337. OCLC 223372888.
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0306465620. OCLC 228374906.
- Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 0198515677. OCLC 48753074.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (édhisi ka-2nd). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505.
{{cite book}}: CS1 maint: multiple names: authors list (link) - Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0674014952.
- Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. ISBN 0313316643. OCLC 50164580.
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 0-13-054091-9. OCLC 47925884.
{{cite book}}: CS1 maint: multiple names: authors list (link) - Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 0801403332. OCLC 17518275.
- Pfeffer, Jeremy I.; Nir, Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 1860942504. OCLC 45900880.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0750302518. OCLC 26853108.
- Scerri, Eric R. (2007). The Periodic Table. Oxford University Press. ISBN 0195305736.
- Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0824708342. OCLC 123346507.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0871699249. OCLC 186607849.
- Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 0764121464. OCLC 51543743.
- Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 0-387-95550-X.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. kc. 213–214. ISBN 074324379X.
- Various (2002). Lide, David R. (èd.). Handbook of Chemistry & Physics (édhisi ka-88th). CRC. ISBN 0849304865. OCLC 179976746. Diarsip saka sing asli ing 2017-07-24. Dibukak ing 2008-05-23.
- Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 0521575079. OCLC 224032426.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company.
- Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0306464039. OCLC 44110319.
- Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (édhisi ka-5th). Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. Dibukak ing 2008-02-05.
Pranala njaba
[besut | besut sumber]| Wikimedia Commons duwé médhia ngenani Atom. |
- Francis, Eden (2002). "Atomic Size". Clackamas Community College. Diarsip saka sing asli ing 2007-02-04. Dibukak ing 2007-01-09.
- Freudenrich, Craig C. "How Atoms Work". How Stuff Works. Dibukak ing 2007-01-09.
- "Atom:The Atom". Free High School Science Texts: Physics. Wikibooks. Diarsip saka sing asli ing 2006-06-13. Dibukak ing 2007-01-09.
- Anonymous (2007). "The atom". Science aid+. Diarsip saka sing asli ing 2011-07-22. Dibukak ing 2007-01-09.
- Anonymous (2006-01-03). "Atoms and Atomic Structure". BBC. Dibukak ing 2007-01-11.
- Various (2006-01-03). "Physics 2000, Table of Contents". University of Colorado. Dibukak ing 2008-01-11.
- Various (2006-02-03). "What does an atom look like?". University of Karlsruhe. Diarsip saka sing asli ing 2010-04-17. Dibukak ing 2008-05-12.

![{\displaystyle {\begin{smallmatrix}1,07{\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73abec12e0273707a961f1ac2a790764a2436904)