Étanol
| Étanol | |
|---|---|
 | |
 |
 |
Etanol | |
Jeneng liya Etil alkohol; hidroksietana; alkohol; etil hidrat; alkohol absolut | |
| Identifikasi | |
| Nomor CAS | [64-17-5] |
| PubChem | |
| Nomer RTECS | KQ6300000 |
| SMILES | CCO |
| InChI | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
| Sifat | |
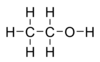
| Rumus molekul | C2H5OH |
| Massa molar | 46,07 g/mol |
| Panampilan | cuwèran tak berwarna |
| Densitas | 0,789 g/cm3 |
| Titik leleh |
−114,3 |
| Titik umob |
78,4 |
| Kelarutan dalam air | tercampur penuh |
| Kaasaman (pKa) | 15,9 |
| Viskositas | 1,200 cP (20 °C) |
| Momen dipol | 1,69 D (gas) |
| Bahaya | |
| Klasifikasi EU | Mudah terbakar (F) |
| NFPA 704 | |
| Frasa-R | R11 |
| Frasa-S | Cithakan:S2 S7 S16 |
| Titik murub | 13 °C (55.4 °F) |
| Senyawa kagandhèng | |
| Senyawa kagandhèng | metanol, propanol |
| Kejaba ditélakaké suwaliké, data ing ndhuwur kanggo ing suhu lan tekanan standar (25°C, 100 kPa) | |
Étanol, diarani uga étil alkohol, alkohol murni, alkohol absolut, utawa alkohol, ya iku jinis cuwèran kang gampang nguwab, gampang kobong, ora ana wernané lan salah siji jinising alkohol kang paling asring digunakaké ing padinan. Senyawa iki minangka obat psikoaktif lan bisa tinemu ing ombèn-ombèn kang ngandhut alkohol lan ing piranti termometer modhèrn.
Étanol kalebu ing alkohol ranté tunggal, kanthi rumus kimia C2H5OH lan rumus empiris C2H6O. Étanol ya iku isomer saka dimetil eter. Étanol asring dicekak dadi EtOH, kanthi "Et" minangka cekakan saka gugus etil (C2H5).
Fèrmèntasi gula dadi étanol ya iku salah sawijiné réaksi organik kang tuwa dhéwé kang tau ditindakaké manungsa. Temahan saka ngonsumsi étanol ya iku bisa nggawé mendem, kang manungsa wis mangertèni wiwit biyèn. Ing jaman modhèrn, étanol diasilaké saka kagunan indhustri pangilangan lenga patro.[1]
Étanol akèh digunakaké minangka panglarud manékabahan kimia kang dituduhaké kanggo konsumsi lan kagunan liyané. Tuladhané ya iku ing lenga wangi, panambah rasa, pawarna panganan, lan usada. Ing kimia, étanol ya iku panglarud kang wigati lan minangka reaktan kanggo sintesis senyawa kimia liyané. Ing sujarahé, étanol minangka bahan bakar.
Sujarah[besut | besut sumber]

Étanol wis digunakaké déning manungsa wiwit jaman prasujarah minangka bahan kang nggawé mendem ing ombèn-ombèn. Residu kang ditemu ing patilasan keramik kang umuré 9000 taun saka Cina pérangan lor nuduhaké bilih ombèn-ombèn alkohol wis digunakaké déning manungsa prasujarah saka jaman Neolitik.[2]
Étanol iku larutan azeotrop. Mula, menawa murnèkaké étanol kang ngandhut banyu kanthi cara panyulingan namung bisa ngasilaké étanol kanthi kamurnian 96%. Étanol murni dikasilaké sepisanan ing taun 1976 déning Johan Tobias Lowitz, ya iku kanthi nyaring alkohol saka prosès lumantar areng.
Lavoisier nggambaraké bilih étanol iku senyawa kang dumadi saka karbon, hidrogen, lan oksigèn. Ing taun 1808, Saussure kasil nemtokaké rumus kimia étanol. Sèket taun sabanjuré (1858), Couper mbabaraké rumus kimia étanol. Mula étanol iku salah sawijiné senyawa kimia kang kapisan tinemu rumus kimiané.[3]
Kanthi kapisah Henry hennel saka Britania Raya lan S.G Serullas saka Perancis, nggawe étanol saka dekomposisi etil hidrogen sulfat ing taun 1826. Ing taun 1828, Michael Faraday kasil nggawé étanol saka hidrasi etilena kang dikatalisis déning asem. Prosès iki kaya prosès sintesis étanol indhustri modern.[4]
Étanol wis digunakaké minangka bahan bakar ing Amérikah Sarékat wiwit taun 1840. Nanging, pajek panggunaané ora ekonomis. Pajek iki dibusak ing taun 1906[5] lan wiwit taun 1908 otomobil Ford Model T wis bisa dilakokaké nggunakaké étanol.[6]
Sipat-sipat fisika[besut | besut sumber]
| 275px | 275px |
| Volum kang punjul campuran étanol karo banyu (kontraksi volume) | Panas pancampuran campuran étanol karo banyu |

|

|
| Kasetimbangan padhet-cuwèr saka campuran étanol lan banyu (kalebu eutektikum) | Wates katercumparan (miscibility gap) ing campuran dodekana lan étanol |
Étanol ya iku cuwèran kang ora ana wernané, gampang nguwab kang nduwé ambu kang khas. Étanol kobong tanpa ninggalaké langes kanthi ilat geni awerna biru.
Sifat-sipat fisika étanol mligi dipangaruhi déning anané gugus hidroksil lan cekaké ranté karbon étanol. Gugus hidroksil bisa mèlu ing jero ikatan hidrogen, saéngga nggawé étanol dadi cuwèr lan luwih angèl nguap saka senyawa organik liyané kanthi massa molekul kang padha.
Étanol ya iku panglarud kang sarwaguna, èncèr ing jero banyu lan panglarud organik liyané, kaya ta asem asetat, aseton, benzena, karbon tetraklorida, kloroform, dietil eter, etilena glikol, gliserol, nitrometana, piridina, lan toluena.[7][8] Étanol uga larud ing hidrokarbon alifatik kang ènthèng, kaya ta pentana dan heksana, lan uga larud ing senyawa klorida alifatik kaya ta trikloroetana lan tetrakloroetilena.[8]
Campuran étanol-banyu nduwé volume kang luwih cilik saka gunggung cuwèran loro mau kanthi kapisah. Campuran étanol lan banyu kanthi volume kang padha bakal ngasilaké campuran kang volumené mung tikel 1,92 saka gunggung volume wiwitan.[7][9] Campuran étanol dan air bersifat eksotermik dengan ènergi sakiwa-tengené 777 J/mol dibebaskan pada 298 K[10].
Campuran étanol lan banyu bakal mbentuk azeotrop dumadi 89% mol étanol lan 11% mo% banyu.[11] Perbandhingan iki uga bisa dinyatakaké minangka 96% volume étanol lan 4% volume banyu ing tekanan normal lan T = 351 K. Komposisi azeotropik iki gumantung banget karo suhu lan tekanan. Étanol bakal ngilang ing tenperatur sangisoré 300 K.[12].

Ikatan hidrogen njalari étanol murni dadi higroskopis banget, saéngga étanol bakal nyerep banyu saka udara. Sifat gugus hidroksil kang polar njalari étanol bisa larit ing akèh senyawa ion, mligi natrium hidroksida, kalium hidroksida, magnesium klorida, kalsium klorida, amonium klorida, amonium bromida, lan natrium bromida.[8] Natrium klorida lan kalium klorida larit sithik ing étanol.[8] Mula étanol uga duwé ranté karbon nonpolar, étanol uga larut ing senyawa nonpolar, kaya ta lenga atsiri.[13] lan akèh perasa, pewarna, lan obat.
Nambahaké sawatara persèn étanol ing banyu akal ngudhunaké tegangan lumah banyu kanthi akèh. Campuran étanol lan banyu kang punjul 50% étanol asifat gampang kebakar lan gampang murub. Campuran kang kurang saka 50% étanol uga bisa murub yèn larutan mau dipanasaké dhisik.
Indeks refraksi étanol ya iku 1,36242 (ing λ=589,3 nm dan 18,35 °C).[7]
Sifat-sipat kimia[besut | besut sumber]
Étanol kalebu alkohol primer, kang tegesé bilih karbon uga talènan karo gugus hidroksil paling ora duwé atom hidrogen loro kang katalèn karo étanol. Rekasi kimia kang dilakokaké déning étanol akèh-akèhé ing saubengé gugus hidroksilé.
Reaksi asem-basa[besut | besut sumber]
Gugus hidroksil étanol nggawé molekul iki rada basa. Étanol mèh nétral ing njero banyu, kanthi pH 100% étanol ya iku 7,33, berbandhing karo pH banyu murni kang gedhéné 7,00. Étanol bisa diowahi dadi konjugat basané, ion etoksida (CH3CH2O−), kanthi ngreaksiké karo logam alkali kaya ta natrium:
utawa karo basa kuat kaya natrium hidrida:
- CH3CH2OH + NaH → CH3CH2ONa + H2.
Reaksi kaya iki ora bisa dilakokaké ing larutan akuatik, amarga banyu luwih asem tinimbang étanol, saéngga kawentuké hidroksida luwih disenengi tinimbang kawentuké etoksida.
Halogenasi[besut | besut sumber]
Étanol bereaksi karo hidrogen halida lan ngaasilaké etil halida kaya ta etil klorida lan etil bromida:
Reaksi karo HCl mrelokaké katalis kaya ta seng klorida.[14] Hidrogen klorida kanthi anané seng klorida dikenal minangka reagen Lucas.[14]
Reaksi karo HBr mrelokaké prosès refluks kanthi katalis asem sulfat.[14]
Etil halida uga bisa dikasilaké kanthi ngreaksiké alkohol lan agen halogenasi kang mirunggan, kaya ta tionil klorida kanggo nggawé etil klorida, utawa fosforus tribromida kanggo nggawé etil bromida.[14]
- CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
Mbentuk ester[besut | besut sumber]
Kanthi kaanan ing sangisoré katalis asem, étanol ngreaksi karo asem karboksilat lan ngasilaké senyawa etil eter lan banyu:
- RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O.
Supaya reaksi iki ngasilaké rendemen kang cukup dhuwur, banyu prelu dipisahaké saka campuran, reaksi dumadakan nalika étanol kawentuk. Étanol uga bisa mbentuk senyawa eter kanthi asem anorganik. Dietil sulfat lan trietil fosfat dikasilaké kanthi ngreaksikaké étanol kanthi asem sulfat lan asem fosfat. Senyawa kang dikasilaké déning reaksi iki migunani banget kanggo agen etilasi ing sintesis organik.
Dehidrasi[besut | besut sumber]
Asam kuat kang higroskopis banget kaya ta asem sulfat bakal njalari dehidrasi étanol ngasilaké etilena utawa dietil eter:
- 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O (ing suhu 120'C)
- CH3CH2OH → H2C=CH2 + H2O (ing suhu 180'C)
Oksidasi[besut | besut sumber]
Étanol bisa dioksidasi dadi asetaldehida, banjur dadi asem asetat. Ing awak manungsa, reaksi oksidadi iki dikatalisis déning enzim awak. Ing laboratorium, larutan akuatik oksidator kaya asem kromat utawa kalium permanganat minangka ngoksidasi étanol dadi asem asetat. Prosès iki bakal angèl banget ngasilaké asetaldehida amarga kadadèn overoksidasi. Étanol uga bisa dioksidasi dadi asetaldehida tanpa oksidasi luwih manèh dadi asem asetat nggunakaké piridinium kloro kromat (Pyridinium chloro chromate, PCC).[14]
- C2H5OH + 2[O] → CH3COOH + H2O
Kasil oksidasi étanol, asem asetat, digunakaké minangka nutrien déning awak manungsa minangka asetil-koA.
Pembakaran[besut | besut sumber]
Pembakaran étanol bakal ngasilaké karbon dioksida lan banyu:
- C2H5OH(g) + 3 O2(g) → 2 CO2(g) + 3 H2O(l);(ΔHr = −1409 kJ/mol[15])
Panggawéan[besut | besut sumber]

Étanol uga dikasilaké kanthi petrokimia lumantar hidrasi etilena utawa kanthi cara biologis lumantar fermentasi gula karo ragi.[16]
Hidrasi etilena[besut | besut sumber]
Étanol kang minangka kabutuhan indhustri asring digawé saka senyawa petrokimia, mligi ya iku lumantar hidrasi etilena:
Katalisa kang digunakaké padatan ya iku asem fosfat[17]. Katalis ini digunakan pertama kali untuk produksi skala besar étanol olèh Shell Oil Company pada taun 1947.[18] Reaksi iki dilakokaké kanthi tekanan uwab kang luwih ing suhu 300 °C.
Prosès suwé kang tau digunakaké ing taun 1930 déning Union Carbide[19] ya iku kanthi ngehidrasi etilena kanthi cara pra langsung lan ngreaksikaké karo asem sulfat pekat kanggo ngasilaké etil sulfat. Etil sulfat banjur dihidrolisis lan ngasilaké étanol:[14]
- C2H4 + H2SO4 → CH3CH2SO4H
- CH3CH2SO4H + H2O → CH3CH2OH + H2SO4
Fermentasi[besut | besut sumber]
Étanol kanggo kagunan konsumsi manungsa kaya ng ombènan kang ngandhut alkohol lan kagunan bahan bakar dikasilaké kanthi cara fermentasi. Spesies ragi tartamtu (tuladhané Saccharomyces cerevisiae) ncerna gula lan ngasilaké étanol lan karbon dioksida:
Prosès ngembangaké ragi kanggo ngasilaké alkohol diarani fermentasi. Konsentrasi étanol kang dhuwur bakal dadi racun kanggo ragi. Ing jinis ragi kang paling toleran tumrap étanol, ragi mau mung bisa tahan ing lingkungan 15% étanol adhédhasar volume.[20]
Kanggo ngasilaké étanol saka bahan-bahan pati, tuladhané serealia, pati mau kudu diowahi dhisik dadi gula. Ing panggawéyan bir, iki bisa dilakokaké kanthi cara ngekum wiji gandum ing jero banyu lan ngenengaké dadi cambah. Wiji gandum kang anyar mau bakal ngasilaké enzim amilase. Wiji cambah gandum didheplok lan amilase kang ana bakal ngowahi pati dadié gula.
Kanggo étanol bahan bakar, hidrolisis pati dadi glukosa bisa dilakokaké luwih rikat nggunakaké asem sulfat èncèe, nambahaké jamur kang bisa ngasilaké amilase, utawa campuran antarané rong cara mau.[21]
Sifat Medis[besut | besut sumber]
Étanol wis kabukti njalari kelainan ing metabolisme lipoprotein, sintesis kolesterol lan pamudhunan sintesis asem empedu, asem kolat, fosfolipid, sarta pamudhunan kagiyatan enzim 12 alpha-hydroxylase.[22]
Panggunaan[besut | besut sumber]
- Pelarut
- Campuran ombènan (intoxicant)
- Sintesis bahan kimia liya
Étanol uga bisa diombé sithik kanthi campuran banyu lan bisa mbiyantu prosès metabolisme.
Cathetan suku[besut | besut sumber]
- ↑ Myers, Richard L.; Myers, Rusty L. (2007). The 100 most important chemical compounds: a reference guide. Westport, Conn.: Greenwood Press. kc. 122. ISBN 0313337586.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Roach, J. (18 Juli 2005) "9,000-Year-Old Beer Re-Created From Chinese Recipe." National Geographic News., diundhuh 14 November 2005.
- ↑ Couper, A.S. (1858). "On a new chemical theory." Philosophical magazine 16, 104–116. Online reprint
- ↑ Hennell, H. (1828). "On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed". Philosophical Transactions. 118 (365–71): 365. doi:10.1098/rstl.1828.0021.
- ↑ Robert Siegel (2007-02-15). "Ethanol, Once Bypassed, Now Surging Ahead". NPR. Dibukak ing 2007-09-22.
- ↑ Joseph DiPardo. "Outlook for Biomass Ethanol Production and Demand" (PDF). United States Department of Energy. Diarsip saka sing asli (PDF) ing 2007-11-27. Dibukak ing 2007-09-22.
- ↑ a b c CRC Handbook of Chemistry, 44th ed.
- ↑ a b c d Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (édhisi ka-9th). Rahway, N.J., U.S.A: Merck. ISBN 0-911910-26-3.
- ↑ "Ethanol". Encyclopedia of chemical technology. Vol. 9. 1991. kc. 813.
- ↑ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). "The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing". Aust J Chem. 33 (10): 2103–19. doi:10.1071/CH9802103.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Lei Z, Wang H, Zhou R, Duan Z (2002). "Influence of salt added to solvent on extractive distillation". Chem Eng J. 87: 149–56. doi:10.1016/S1385-8947(01)00211-X.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Pemberton RC, Mash CJ (September 1978). "Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 to 363.15 K determined by an accurate static method". J Chem Thermodyn. 10 (9): 867–88. doi:10.1016/0021-9614(78)90160-X.
- ↑ Merck Index of Chemicals and Drugs, 9th ed.; monographs 6575 through 6669
- ↑ a b c d e f Streitweiser, Andrew Jr.; Heathcock, Clayton H. (1976). Introduction to Organic Chemistry. MacMillan. ISBN 0-02-418010-6.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Frederick D. Rossini (1937). "Heats of Formation of Simple Organic Molecules". Ind. Eng. Chem. 29 (12): 1424–1430. doi:10.1021/ie50336a024.
- ↑ Mills, G.A.; Ecklund, E.E. "Mills GA, Ecklund EE (1987). "Alcohols as Components of Transportation Fuels". Annual Review of Energy. 12: 47–80. doi:10.1146/annurev.eg.12.110187.000403.
- ↑ Roberts, John D.; Caserio, Marjorie C. (1977). Basic Principles of Organic Chemistry. W. A. Benjamin, Inc. ISBN 0-8053-8329-8.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ "Ethanol". Encyclopedia of chemical technology. Vol. 9. 1991. kc. 82-.
- ↑ Lodgsdon, J.E. (1994). p. 817
- ↑ Morais PB, Rosa CA, Linardi VR, Carazza F, Nonato EA (November 1996). "Production of fuel alcohol by Saccharomyces strains from tropical habitats". Biotechnology Letters. 18 (11): 1351–6. doi:10.1007/BF00129969.
{{cite journal}}: CS1 maint: multiple names: authors list (link)[pranala mati permanèn] - ↑ Badger, P.C. "Ethanol From Cellulose: A General Review." p. 17–21. In: J. Janick and A. Whipkey (eds.), Trends in new crops and new uses. ASHS Press, 2002, Alexandria, VA. Retrieved on September 2, 2007.
- ↑ "Effects of acute and chronic ethanol intake on bile acid metabolism". Monroe P, Vlahcevic ZR, Swell L. Dibukak ing 2010-11-18.


