Hemoglobin
Artikel iki prelu dirapèkaké supaya jumbuh karo wewaton artikel WikipédiaPanjenengan bisa mbiyantu ngrapèkaké artikel iki kanthi mérang dadi paragraf-paragraf utawa wikifikasi. Sawisé dirapèkaké, tandha iki kena dibusak. |
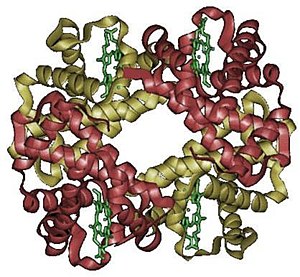
Hemoglobin ya iku metaloprotein (protéin kang ngandhut zat besi) ing jero sèl getih abang kang nduwé kagunan minangka pengangkut oksigèn saka paru-paru tumuju kabèh pérangan awak,[1] ing mamalia lan kéwan liyané. Hemoglobin uga ngusungi karbon dioksida mbalik menyang paru-paru kanggo ditokaké metu saka awak.[2] Molekul hemoglobin kawangun saka globin, apoprotein, lan patang gugus heme, siji molekul organik kanthi siji atom besi.[2] Mutasi ing gèn protéin hemoglobin njalari siji golongan lelara nurun kang diarani hemoglobinopati, ing antarané kang paling asring tinemu ya iku anemia sèl sabit lan talasemia.[2]
Struktur[besut | besut sumber]

Hemoglobin duwé struktur kang bisa diudhar.[3] Struktur hemoglobin kawangun saka sawatra unit. Ing punjer molekul kawangun saka cincin heterosiklik kang diarani porfirin kang nahan siji atom besi, atom besi iki minangka lokal talènan oksigèn.[3] Porfirin kang ngandhut besi diarani heme. Hemoglobin kasusun saka patang molekul protéin (globulin chain) kang kahubung antara siji lan sijiné.[3] hemoglobin norma wong diwasa (HbA) kawangun saka 2 alpha-globulin chains lan 2 beta-globulin chains, déné ing bayi kang isih ing njero kandhutan utawa wis lair kawangun saka sawatéara ranté beta lan molekul hemoglobin kang kawentuk saka 2 ranté alfa lan 2 ranté gama kang diarani HbF.[3] Ing manungsa diwasa hemoglobin wujud tetramer (ngandhut 4 subunit protéin), kang kawangun saka 2 subunit alfa lan beta saben tentramer.[3] tentramer iku kagubet kanthi cara nonkovalen. Subunit-subunité kayaé sétruktural lan ukurané arep padha.[3] Saben subunit nduwé bobot molekul kurang saka 16,000 Dalton, saéngga bobot molekul total tentramer dadi kira-kira 64,000 Dalton.[3] Saben subunit hemoglobin ngandhut siji heme, saéngga kabèh hemoglobin nduwé kapasitas patang molekul oksigèn.[3] Zat heme iki sing ndadèkaké getih wernané abang.[3]
Reaksi bertahap:
- Hb + O2 <-> HbO2
- HbO2 + O2 <-> Hb(O2)2
- Hb(O2)2 + O2 <-> Hb(O2)3
- Hb(O2)3 + O2 <-> Hb(O2)4
Reaksi keseluruhan:
- Hb + 4O2 -> Hb(O2)4
Kagunan[besut | besut sumber]
- Transpor oksigèn
hemoglobin nduwé kemampuan kanggo nalèni oksigèn kanthi lemah lan kanthi cara reversibel.[4] Kagunan hemoglobin ing awak gumantung ing kemampuan kanggo talènan karo oksigèn ing jero peru-peru banjur ngeculaké oksigèn iku tumuju kapiler jaringan ing endi tekanan gas saka oksigèn adoh luwih sithik tinimbang ing jero pari-paru.[4] Saben molekul hemoglobin ngandhut patang atom besi lan bisa ngangkud molekul oksigèn.[4] Nalika nindakaké fungsiné nggawa oksigèn menyang kabèh pérangan awak, hemoglobin nalèni oksigèn lumantar talènan kimia mirunggan.[4] Reaksi kang minangka talènanan antara Hb lan oksigèn mau bisa ditulis:
Hb + O2 <-----> HbO2
- Transportasi karbondioksida dan ion hidrogen
Ing konsèntrasi karbondioksia dhuwur lan pH cendhak, kaya ing jero jaringan, sawatara pérangan karbondioksida bakal ditalèni déning hemoglobin.[4] Daya tali tumrap oksigèn bakal mudhun, saéngga oksigèn diculaké.[4] Suwaliké nalika ditalèni ing jero paru-paru, daya tali hemoglobin kanggo karbondioksida mudhun.[4] Dadi, kejenuhan hemoglobin diprabawani déning pH lan konsèntrasi karbondioksida.[4]
Wujud Hemoglobin[besut | besut sumber]
Hemoglobin kawentuk saka sawatara bentuk,[5] ya iku:
- Oksihaemoglobin, hemoglobin tanpa oksigèn (hemoglobin tereduksi) kang nduwé warna ungu enom, hemoglobin teroksidasi kebak kanthi saben pasangan heme+globulin nggawa atom oksigèn 2, awerna kuning abang.[5] Lambang oksihemoglobin ya iku HbO8, nanging HbO2 ya iku konvensional.[5]
- Karboksihaemoglobin, minangka karbon monoksida kang ditalèni marang hemoglobin ping 200 luwih gedhé tinimbang oksigèn.[5] Saéngga ana karbon monoksida, mula luwih bisa kawentuk karboksihaemoglobin.[5] karboksihaemoglobin awerna abang cèri, mligi ing larutan cuwèr.[5]
- Methaemoglobin, minangka hementin-globin kang ngandhut FeIII- OH (symbol: Hi), methaemoglobin ora bisa ngangkud oksigèn aknggo ambegan.[5]
- Suiphaemoglobin, minangka struktur kang ora tetep, kang ana gegayutané karo methaemoglobin lan uga ora bisa ngangkud oksigèn ambegan.[5] Dituwuhaké déning obat-obatan, pengawèt panganan, lan banyu wédang kang kena polusi.[5]
- Haemoglobin terglikosilasi, minangka haemoglobin kang ditalèni menyang glukosa kanggo minangka derivate kang stabil tumrap panguripané eritrosit.[5]
- Mioglobin. minangka hemoglobin kang disedherhanakaké, ana ing otot balung lan jantung.[5] Ing papan mioglobin uga bisa makarya minangka reservoir oksigèn kang sithik lan diculaké sawisé iskemia amarga bobot molekul cendhak, mioglobin bisa rikat doresiki saka plasma lan ana mingangka mioglobinuria.[5] Mioglobinuria ya iku indeks karusakan sèl ototkang sènsitif saka obahé awak.[5]
- Haptoglobin, minangka globulin spèsifik kang nalèni hemoglobin ing globin.[5] Kagunané kanggo ngéwahi zat besi sawisé hemeolisa intravakuler. Haptoglobin nalèni hemoglobin kira-kira 1,25 g/l plasma lan mung konsèntrasi iku ana hemoglobin bébas kang ilang ing uyuh lan katalèn menyang haemopeksin.[5]
- Haemopeksin, minangka glikoprotein kang katalèn karo sisa haemoglobin. Konsentrasiné ing jero plasma normal ya iku kira-kira 0,5 g/l.[5]
- Methaemalbumin, minangka komponèn hemeatin + albumin, awerna coklat lan ana ing jero plasma kang mesthi normal.[5] Jalaran Methaemalbuminemia liya ya iku perdharahan menyang kavitas abdominalais utawa pankreatis haemoragika akuta, pencernaan déning pankreas ngowahi hemoglobin dadi hematin kang diabsorbsi lan ditalèni menyang albumin plasma.[5]
Pranala njaba[besut | besut sumber]
- 1A3N Archived 2006-02-27 at the Wayback Machine. - PDB struktur hemoglobin Manusia.
Cathetan suku[besut | besut sumber]
- ↑ "Hemoglobin". WebMD. Dibukak ing 20 Fèbruari 2012.
- ↑ a b c Hemoglobin(diundhuh 20 Januari 2013)
- ↑ a b c d e f g h i Struktur Hemoglobin(diundhuh 20 Januari 2013)
- ↑ a b c d e f g h Fungsi Hemoglobin(diundhuh 20 januari 2013)
- ↑ a b c d e f g h i j k l m n o p q r Macam dan Fungsi Hemoglobin Archived 2012-12-01 at the Wayback Machine.(diundhuh 20 januari 2013)
