Asem amino
Asem amino iku sembarang senyawa organik kang duwé gugus fungsional karboksil (-COOH) lan amina (lumrahé-NH2).Ing biokimia asring artiné diciutaké: loro-loroné kaiket ing siji atom karbon (C) kang padha (karan atom C "alfa" utawa α). Gugus karboksil mènèhi sipat asem lan gugus amina mènèhi sipat basa. Yèn wanguné larutan, asem amino duwé sipat amfoterik: cenderung dadi asem ing larutan basa lan dadi basa ing larutan asem. Prilaku iki bisa kedadèn yèn asem amino dadi zwitter-ion. Asem amino kagolong senyawa kang paling akèh disinaoni amarga salah sawijiné fungsiné wigati banget ing organisme, yaiku minangka panyusun protéin.
Struktur asem amino
[besut | besut sumber]
Struktur asem amino lumrahé yaiku siji atom C kang ngiket papat gugus: gugus amina (NH2), gugus karboksil (COOH), atom hidrogen (H), lan siji gugus sisa (R, teka residue) utawa karan uga gugus utawa ranté samping kang mbédakaké sawijining asem amino karo asem amino liyané.
Atom C pusat dijenengi atom Cα ("C-alfa") selaras karo mènèhi jeneng senyawa kang gugusé karboksil, yaiku atom C kang iketané langsung karo gugus karboksil. Mula gugus amina uga keiket ing atom Cα iki, senyawa mau iku asem α-amino.
Asem amino lumrahé diklasifikasikaké miturut sipat kimia ranté samping mau dadi patang golongan. Ranté samping bisa gawé asem amino duwé sipat asem lemah, basa lemah, hidrofilik yèn polar, lan hidrofobik yèn nonpolar.
Isomerisme ing asem amino
[besut | besut sumber]
Amerga atom C pusat nalèni papat gugus kang béda, mula asem amino—kejaba glisina—duwé isomer optik: l lan d. Cara prasaja kanggo ngidhèntifikasi isomeri iki saka gambar rong dhimènsi yaiku nganggo cara "nyurung" atom H menyang mburi pamaca (ngadohi wong kang maca). Upama saarah ubengan dom jam (ubengan menyang tengen) ndadèkaké urutan karboksil-residu-amina mula iki mau tipe d. Upama urutan iki kedadèn saka arah ubengan walikané dom jam, mula iku mau tipe l. (Aturan iki diteèpungi ing basa Inggris CORN, saka singkatan COOH-R-NH2).
Lumrahé, asem amino alami kang diasilaké eukariota iku tipe l sanajan sapérangan kéong laut ngasilaké tipe d. Dhindhing sèl bakteri akèh ngandung asem amino d.
Polimerisasi asem amino
[besut | besut sumber]Deleng uga artikel èksprèsi genetik.

Protein kagolong polimer kang kasusun saka asem amino kang dadi monomeré. Monomer-monomer iki kesambung karo roncèn peptida, kang ngiket gugus karboksil duwèkané sawijining monomer karo gugus amina duwèkané monomer sisihé. Réaksi kang nyambungaké iki (karan translasi) kang alami kedadèn ing sitoplasma kang diéwangi ribosom lan tRNA.
Ing polimerisasi asem amino, gugus-OH kang dadi pérangan gugus karboksil sawijining asem amino lan gugus-H kang dadi pérangan gugus amina asem amino liyané ucul lan mbentuk banyu. Mula, réaksi iki kagolong réaksi dehidrasi. Molekul asem amino kang wis ngeculaké molekul banyu dijenengi wangun résidhu asem amino.
Zwitter-ion
[besut | besut sumber]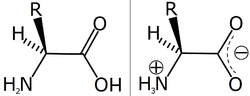
Amarga asem amino duwé gugus aktif amina lan karboksil sisan, dat iki dianggep asem lan basa (yèn sabeneré pH alaminé lumrahé diprabawai gugus-R kang diduwèni). Ing pH tinentu kang karan titik isolistrik, gugus amina ing asem amino dadi duwé momotan positif (kaprotonasi, –NH3+), lan gugus karboksilé dadi duwé momotan négatif (kadeprotonasi, –COO-). Titik isolistrik iki spésifik gumantung ing jinis asem aminoné. Ing kaanan iki, asem amino duwé wangun zwitter-ion. Zwitter-ion bisa dièkstrak saka larutan asem amino kang dadi struktur kristal putih kang duwé titik lebur kang dhuwur amarga sipat dipolaré. Akèh-akèhé asem amino bébas ana ing wangun zwitter-ion ing pH nétral uga pH fisiologis kang cedhak nétral. Amarga duwé momotan négatif lan positif, asem amino bisa ngalami réaksi marang asem uga basa.[1]
Asem amino dhasar (standar)
[besut | besut sumber]Protein disusun saka sapérangan asem amino kang digandhèngaké déning roncèn peptida. Sanajan mangkono, ing awal pambentukané protéin mung kasusun saka 20 asem amino kang ditepungi kanthi jeneng asem amino dhasar utawa asem amino baku utawa asem amino kang nyusun protéin (proteinogenik). Ya asem-asem amino iki kang disandhi déning DNA/RNA kanggo kodhe genetik.
Ing ngisor iki 20 asem amino kang nyusun protéin (singkatan ing kurung nuduhaké singkatan telung huruf lan sakhuruf kang asring kanggo ing kajian protéin), diklompokaké miturut sipat utawa struktur kimiawiné:
Asem amino alifatik prasaja
[besut | besut sumber]- Glisina (Gly, G)
- Alanina (Ala, A)
- Valina (Val, V)
- Leusina (Leu, L)
- Isoleusina (Ile, I)
Asem amino hidroksi-alifatik
[besut | besut sumber]Asem amino dikarboksilat (asem)
[besut | besut sumber]- Asem aspartat (Asp, D)
- Asem glutamat (Glu, E)
Amida
[besut | besut sumber]- Asparagina (Asn, N)
- Glutamina (Gln, Q)
Asem amino basa
[besut | besut sumber]Asem amino karo sulfur
[besut | besut sumber]Prolin
[besut | besut sumber]- Prolina (Pro, P) (duwé gugus siklik)
Asem amino aromatik
[besut | besut sumber]- Fenilalanina (Phe, F)
- Tirosina (Tyr, Y)
- Triptofan (Trp, W)
Golongan iki duwé cincin benzena lan dadi bahan baku metabolit sekunder aromatik.
Fungsi biologi asem amino
[besut | besut sumber]- Panyusun protéin, kagolong enzim.
- Rangka dhasar sapérangan senyawa wigati ing metabolisme (mligi vitamin, hormon lan asem nukleat).
- Pangiket ion logam wigaèti kang diperlokaké ing réaksi enzimatik (kofaktor).
Asem amino esensial
[besut | besut sumber]Asem amino digunakaké makluk urip kanggo nyusun protéin utawa kanggo rangka molekul-molekul wigati. Iki karan esensial ing spésies organisme yèn spésies iku merlokaké nanging ora mampu mrodhuksi dhéwé utawa terus kekurangan asem amino. Kangggo nyukupi kabutuhané iki, spésies iku kudu masok saka njaba (lumantar panganan). Istilah "asem amino esensial" iki mung kanggo organisme heterotrof.
Kanggo manungsa, ana 8 (ana kang nyebutaké 9) asem amino esensial kang kudu dicukupi saka dièt sadina-dina, yaiku isoleusina, leusina, lisina, metionina, fenilalanina, treonina, triptofan, lan valina. Histidina lan arginina mau "setengah esensial" amarga awak manungsa diwasa séhat bisa nyukupi kabutuhané. Asem amino karnitina uga duwé sipat "setengah esensial" lan asring diwènèhaké kanggo kepentingan pangobatan.
Deleng uga
[besut | besut sumber]- Asem jengkolat, sawijining asem amino kang njalari tandha-tandha "jengkolen"
Réferènsi
[besut | besut sumber]- ↑ "Réaksi Asam Basa Marang Asam Amino". Diarsip saka sing asli ing 2022-08-14. Dibukak ing 2018-10-15.
Pranala njaba
[besut | besut sumber]- Situs iki ngamot biosintesis manéka asem amino panyusun protéin [1]
