Hukum Boyle
Artikel iki prelu dirapèkaké supaya jumbuh karo wewaton artikel WikipédiaPanjenengan bisa mbiyantu ngrapèkaké artikel iki kanthi mérang dadi paragraf-paragraf utawa wikifikasi. Sawisé dirapèkaké, tandha iki kena dibusak. |
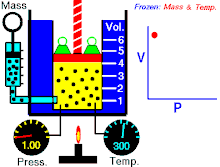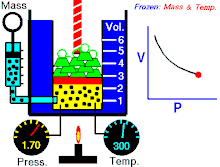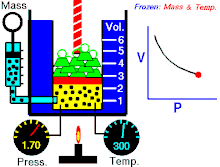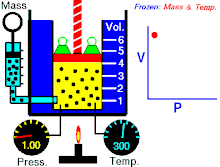
Hukum Boyle (asring direferensiké minangka Hukum Boyle-Mariotte) ya iku salah sawijiné hukum kimia lan minangka prakara mirunggan saka hukum kimia ideal. Hukum Boyle njlèntrèhaké kuwalikan gayutan proporso antarané tekanan absolut lan volume hawa yèn suhu tetep ajeg ing sistem katutup.[1][2] Hukum iki dijenengi sawisé kimiawan lan fisikawan Robert Boyle kang nerbitaké hukum asliné ing taun 1662.[3]
Isi[besut | besut sumber]
Isi hukum Boyle ya iku:
Untuk jumlah tetap gas ideal tetap di suhu yang sama, P [tekanan] dan V [volume] merupakan proporsional terbalik (dimana yang satu ganda, yang satunya setengahnya).
— [2]
"Kanggo cacah tetep gas ideal tetep ing suhu kang padha, P tekanan lan V volume minangka proporsional kuwalik (ing endi sing siji rangkep, sing sijiné setengahé)."
Sajarah[besut | besut sumber]

Hubungan antarané tekanan lan volume sepisanan dicathet déning èlmuwan amatir Richard Towneley lan Henry Power. Boyle mesthèkaké panalitiyan lan parcobaané sakloron lan nerbitaké asilé. Miturut katrangan saka Robert Gunther lan otoritas liya kang nalika iku dadi asisten Boyle ya iku Robert Hooke kang bisa nggawé piranti parcobaan. Hukum Boyle ya iku miturut parcobaan karo hawa, ing endi Boyle mratimbangaké anané partikel fluida ing tengah sumber banyu kang ora bisa didelok. Nalika iku, hawa isih kétok minangka siji saka patang elemen, nanging Boyle ora sarujuk. Miturut Boyle ya iku kanggo mangertèni yèn hawa iku pérangan wigati ing panguripan.[4] Boyle ngandharaké minangka tuladha tuwuhé tetuwuhan tanpa hawa.[5] Fisikawan Perancis, Edme Mariotte (1620-1684) uga nemu hukum kang padha kanthi kepisah karo Boyle ing taun 1676, nanging Boyle wis ngandharaké hukum mau taun 1662. Banjur ing taun 1687, ing Philosophiæ Naturalis Principia Mathematica, Newton nuduhaké kanthi cara matematis yèn fluida elastis iku isiné sisa partikel ing tengah kekuwatan repulsif kanthi proporsional kang kuwalik tumrap dohé. Kepadhetané kanthi proporsional langsung tumrap tekanan.[6] Nanging risalah matematis dudu panjlèntrèhan kanthi èlmu fisika tumrap gayutan pengamatan. Tinimbang téyori statis, téyori kinetis dibutuhaké ing endi tinemu déning Maxwell lan Boltzmann.
Persamaan[besut | besut sumber]
Persamaan matematis kanggo Hukum Boyle ya iku:
katrangan:
- p tegesé sistem tekanan.
- V tegesé volume hawa.
- k ya iku cacah ajeg tekanan lan volume saka sistem mau.
Nalika suhu tetep ajeg, cacahé ènèrgi kang padha mènèhi sistem padha plek sasuwéné operasi. Kanthi teoritis, gunggungé k bakal tetep ajeg. Nanging, amarga penyimpangan kang arahé jejeg lurus ditrapaké, bisa waé kekuwatan probabilistik tabrakan karo pertikel liya, kaya ta téyori tabrakan, aplikasi kekuwatan lumah ora bisa ajeg kanthi ora ana watesé kaya gunggungé k. Nanging bakal nduwé batas ing endi perbedaan gunggung mau tumrap a. Kekuwatan volume v saka kuantitas tetep hawa munggah, ngukuhaké hawa saka suhu kang wis diukur, tekanan p kudu mudhun kanthi pas. Yèn diowahi, ngudhunaké volume hawa padha karo ngundhakaké tekanan.
Padatan Hukum Boyle minangka ngira-ngira kasil ngenalaké éwah-éwahan ing volume lan tekanan tumrap kaanan kang padha karo kaanan tetep hawa. Sadurungé lan sawisé volume lan tekanan tetep minangka gunggung saka hawa, ing endi sadurungé lan sawisé suhu tetep (panas lan adhem bisa dibutuhaké kanggo kaanan iki), gayutan persamaané ya iku:
Hukum Boyle, Hukum Charles, dan Hukum Gay-Lusaac ngasilaké hukum kombinasi udara. Telung hukum hawa mau berkombinasi karo Hukum Avogadro lan dipadhaké karo hukum udara ideal.
Hubungan karo téyori kinetis lan udara ideal[besut | besut sumber]
Hukum Boye nyatakaké déné ing suhu tetep kanggo massa kang padha, tekanan absolut lan volume hawa kuwalik kanthi proporsional. Hukum iki uga bisa dinyatakaké minangka: kanthi rada béda, kasil saka tekanan absolut lan volume mesthi ajeg. Akèh-akèhé hawa lumaku kaya hawa ideal nalika tekanan lan suhu cukup. Teknologi ing abad kaping 17 ora bisa ngasilaké tekanan dhuwur utawa suhu cendhak. nanging, hukum ora mungkin slénco nalika dipublikasikaké. Minangka kemajuan ing babagan teknologi, ngidini tekanan lan volume mung bisa pas (akurat), dijlèntrèhaké minangka téyori hawa kang sebenerè.[7] Penyimpangan ini karan sebagai faktor kompresibilitas.
Robert Boyle lan Edme Mariotte ngandharaké déné hukum mau asalé saka parcobaan kang ditindakaké déning kekaroné. Hukum iiki uga bisa saka téyori, miturut anggepan yèn atom lan molekul sarta anggepan babagan obah lan elastis sampurna. Anggepan mau tinemu kanthi resisten apik ing komunitas èlmiah positif nalika iku. Nanging, nalika kétok, anggepan mau minangka konstruksi teoritis murni kang ora ana buktiné.
Ing taun 1738, Daniel Bernoulli ngrembakaké téyori Boyle nggunakaké Hukum Newton karo aplikasi tingkat molekul. Iki tetep ora digatèkaké nganti kira-kira ing taun 1845, ing endi John Waterston nerbitaké yasan kertas kanthi presepsi utama ya iku téyori kinetis, nanging uga oraa digatèkaké déning Royal Society of England. Banjur James Prescott Joule, Rudolf Clausius, lan Ludwig Boltzmann nerbitaké téyori kinetis hawa lan naraik kawigatèn téyori Bernoulli lan Waterston.[8]
Debat antarané proponen energetika lan atomisme ngeteraké Boltzman kanggo nulis buku ing taun 1898, ing endi ngasilaké kritik lan njalari dhèwèké lampus dhiri ing taun 1906.[8] Albert Einstein, ing taun 1905 nuduhaké kepriyé téyori kinetis bisa lumaku ing Gerakan Brown kanthi partikel kang isiné fluida, dipastèkaké ing taun 1908 déning Jean Perrin.[8]
Tuladha penggunaan[besut | besut sumber]
- Pergantian tekanan ing piranti suntik
- Nyebul plendhungan
- Ningkataké ukuran gelembung naika munggah ing lumah
- Matiné makluk sagara amarga ana owah-owahan tekanan
- Masalah ing kuping naika ing papan kang dhuwur
Gladri[besut | besut sumber]
Uga delengen[besut | besut sumber]
Cathetan suku[besut | besut sumber]
- ↑ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ↑ a b Levine, Ira. N. (1978), p12 gives the original definition.
- ↑ J Appl Physiol 98: 31-39, 2005. Free download at Jap.physiology.org
- ↑ The Boyle Papers BP 9, fol. 75v-76r at BBK.ac.uk Archived 2009-11-22 at the Wayback Machine.
- ↑ The Boyle Papers, BP 10, fol. 138v-139r at BBK.ac.uk Archived 2009-11-22 at the Wayback Machine.
- ↑ Principia, Sec.V,prop. XXI, Theorem XVI
- ↑ Levine, Ira. N. (1978), p11 notes that deviations occur with high pressures and temperatures.
- ↑ a b c Levine, Ira. N. (1978), p400--Historical background of Boyle's law relation to Kinetic Theory



