Réaksi kimia: Béda antara owahan
- hilangkan inuse |
Tanpa ringkesan besutan |
||
| Larik 1: | Larik 1: | ||
[[Gambar:Hydrochloric acid ammonia.jpg|right|250px|thumb|Uap [[hidrogen klorida]] dalam beker dan [[amonia]] dalam tabung percobaan bereaksi membentuk awan [[amonium klorida]]]] |
[[Gambar:Hydrochloric acid ammonia.jpg|right|250px|thumb|Uap [[hidrogen klorida]] dalam beker dan [[amonia]] dalam tabung percobaan bereaksi membentuk awan [[amonium klorida]]]] |
||
[[Gambar:ThermiteFe2O3.JPG|miniatur|[[Thermitreaktion]]]] |
[[Gambar:ThermiteFe2O3.JPG|miniatur|[[Thermitreaktion]]]] |
||
'''Réaksi kimia''' inggih punika prosés alam ingkang asring ngasilakén ewahan [[Senyawa Kimia]].<ref>{{id}}[GoldBookRef|title=chemical reaction|file=C01033 Pengertian Reaksi Kimia](dipununduh Tanggal 30 September 2012)</ref>Sényawa utawi sényawa-sényawa wiwit ingkang gégayutan ing réaksi sagéd dipunsébapaken dados [[réaktan]]. Réaksi kimia dipunkaraktérisasikakén kaliyan [[Pérubahan kimiawi]], lan badhè ngasilakén sétunggal utawi langkung [[produk]] ingkang |
'''Réaksi kimia''' inggih punika prosés alam ingkang asring ngasilakén ewahan [[Senyawa Kimia]].<ref>{{id}}[GoldBookRef|title=chemical reaction|file=C01033 Pengertian Reaksi Kimia](dipununduh Tanggal 30 September 2012)</ref>Sényawa utawi sényawa-sényawa wiwit ingkang gégayutan ing réaksi sagéd dipunsébapaken dados [[réaktan]]. Réaksi kimia dipunkaraktérisasikakén kaliyan [[Pérubahan kimiawi]], lan badhè ngasilakén sétunggal utawi langkung [[produk]] ingkang nggadahi titikan ingkang bèntén saking réaktan. Sécara klasik, réaksi kimia ngayutakén kaewahan pérgérakan [[Èlèktron]] ing pémbéntukan lan pémutusan [[ikatan kimia]], ménawi konsèp umum réaksi kimia ugi sagéd dipuntérapakè ing [[diagram Feynman|transformasi partikel-partikel elementer]] sami kaliyan [[reaksi nuklir]]. |
||
Reaksi-reaksi kimia ingkang panggenanipun dipunginakaken sami ing [[sintesis kimia]] kanggé ngasilakné produk senyawa ingkang |
Reaksi-reaksi kimia ingkang panggenanipun dipunginakaken sami ing [[sintesis kimia]] kanggé ngasilakné produk senyawa ingkang sampun dados ancasipun. Ing salébéting [[biokimia]] reaksi kimia dipun[[katalisis]] kaliyan [[enzim]] mbéntuk lintasan [[métabolismé]], ing sintesèis saha [[dekomposisi]] ingkang biasanipun botén kédadosan ing [[sèl]] |
||
== Séjarah == |
== Séjarah == |
||
[[Gambar:Antoine lavoisier color.jpg|thumb|[[Antoine Lavoisier]] mengembangkan teori pembakaran minangka reaksi kimia kaliyan oksigen]] |
[[Gambar:Antoine lavoisier color.jpg|thumb|[[Antoine Lavoisier]] mengembangkan teori pembakaran minangka reaksi kimia kaliyan oksigen]] |
||
[[Gambar:ThermiteReaction.jpg|thumb|A [[thermite]] reaction using iron(III) oxide. The sparks flying outwards are globules of molten iron trailing smoke in their wake.]] |
[[Gambar:ThermiteReaction.jpg|thumb|A [[thermite]] reaction using iron(III) oxide. The sparks flying outwards are globules of molten iron trailing smoke in their wake.]] |
||
[[Gambar:Chemical reactions3.ogv|thumb|Video demonstrating a chemical reaction.]] |
[[Gambar:Chemical reactions3.ogv|thumb|Video demonstrating a chemical reaction.]] |
||
Rèaksi kimia |
Rèaksi kimia kadasta [[pembakaran]], [[férméntasi]], lan rèduksi saking bijih dados logam sampun dipunmangértosi jaman rumiyèn.Téori-téori wiwit transformasi saking matérial-matérial punika dirémbakaké dèning filsuf [[Yunani ]]Kina, kadas [[Èlèmèn klasik]] saking [[Empedocles]] ingkang ngendika ménawi substansi kèmawon kasusun saking èlèmèn dasar inggih punika : [[Lati]],[[ toya]], [[udara]], lan [[bu.ing abad perètengahan, transformasi kimia dipunsinauni dèning para [[alkemis]]. Sédaya nyobi, tuladhanipun, ngubah [[timbal]] dados [[émas]], kaliyan ngèrèaksiakén [[timbal]] kaliyan campuran [[témbaga]] [[timbal]] kaliyan [[sulfur]].<ref>{{id}}[cite journal|last1=Weyer|first1=Jost|title=Neuere Interpretationsmglichkeiten der Alchemie|volume=7|pages=177|journal=Chemie in unserer Zeit|language=German|year=1973|doi=10.1002/ciuz.19730070604|issue=6 Sejarah Reaksi Kimia] (dipununduh Tanggal 30 September)</ref> |
||
Produksi saking sényawa-sényawa kimia ingkang botén wontén sécara alami ing donya, sampun lami para ilmuan, kados sintèsis saking [[asam sulfur]] lan [[asam nitrat]] saking alkemis [[Jābir ibn Hayyān]]. Prosès punika dipunlampahi kanthi cara béntérakèn [[minéral-minéral]] [[sulfat]], saha [[nitrat]], kados [[témbaga sulfat]], [[alum]] lan [[kalium nitrat]]. Ing abad ke-17, [[Johann Rudolph Glauber]] mroduksi [[asam klorida]] lan [[natrium sulfat]] kaliyan ngréaksiakén [[asam sulfat]] kaliyan [[natrium klorida]]. Wontén ananè parémbagan ''[[lead chamber process]]'' ing taun [[1746]] lan [[prosès Leblanc]], pramila ménawi |
Produksi saking sényawa-sényawa kimia ingkang botén wontén sécara alami ing donya, sampun lami para ilmuan, kados sintèsis saking [[asam sulfur]] lan [[asam nitrat]] saking alkemis [[Jābir ibn Hayyān]]. Prosès punika dipunlampahi kanthi cara béntérakèn [[minéral-minéral]] [[sulfat]], saha [[nitrat]], kados [[témbaga sulfat]], [[alum]] lan [[kalium nitrat]]. Ing abad ke-17, [[Johann Rudolph Glauber]] mroduksi [[asam klorida]] lan [[natrium sulfat]] kaliyan ngréaksiakén [[asam sulfat]] kaliyan [[natrium klorida]]. Wontén ananè parémbagan ''[[lead chamber process]]'' ing taun [[1746]] lan [[prosès Leblanc]], pramila ménawi wontén [[asam sulfat]] lan [[natrium karbonat]] ing jumlah agéng, mila rèaksi kimia sagéd dipun aplikasikakén ing industri. Tèknologi [[asam sulfat]] sampun majéng, pungkasaning sagéd ngasilakén [[prosès kontak]] ing taun [[1880]]-an,<ref>{{id}}Leonard J. Friedman & Samantha J. Friedman [http://www.aiche-cf.org/Clearwater/2008/Paper2/8.2.7.pdf The History of the Contact Sulfuric Acid Process], Acid Engineering & Consulting, Inc. Boca Raton, Florida] (dipununduh Tanggal 30 September 2012)</ref> lan [[proses Haber]] dipunembagagen ing taun 1909–1910 kangge sintesis [[amonia]].<ref>John E. Lesch [http://books.google.com/books?id=VJIztvolC8cC&pg=PA170 The German chemical industry in the twentieth century], Springer, 2000, ISBN 0-7923-6487-2 p. 170 Sejarah Reaksi Kimia]</ref> |
||
Saking abad 16 peneliti kayadene [[Jan Baptist van Helmont]], [[Robert Boyle]] saha [[Isaac Newton]]nyobi kanggè némtuakén tèori-tèori saking transformasi-transformasi kimia ingkang sampun dipuneksperimenaken ing [[Tèori plogiston]] dipuncetusaken ing taun [[1667]] dèning [[Johann Joachim Becher]]. Téori punika mempostulataken ananè èlèmèn kayadènè [[lati]] ingkang sagéd dipunwastani "plogiston", ing salébéting benda-benda ingkang sagét kabakar saha dipunuwalakén ngantas [[pembakaran]]. Teori punika dipunbuktiaken luput ing taun [[1785]] dèning [[Antoine Lavoisier]], ing pungkasan nyukani pangèrtosan ingkang lérés babakan pembakaran.<ref>Brock, pp. 34–55</ref> |
Saking abad 16 peneliti kayadene [[Jan Baptist van Helmont]], [[Robert Boyle]] saha [[Isaac Newton]]nyobi kanggè némtuakén tèori-tèori saking transformasi-transformasi kimia ingkang sampun dipuneksperimenaken ing [[Tèori plogiston]] dipuncetusaken ing taun [[1667]] dèning [[Johann Joachim Becher]]. Téori punika mempostulataken ananè èlèmèn kayadènè [[lati]] ingkang sagéd dipunwastani "plogiston", ing salébéting benda-benda ingkang sagét kabakar saha dipunuwalakén ngantas [[pembakaran]]. Teori punika dipunbuktiaken luput ing taun [[1785]] dèning [[Antoine Lavoisier]], ing pungkasan nyukani pangèrtosan ingkang lérés babakan pembakaran.<ref>Brock, pp. 34–55</ref> |
||
Ing taun[[ 1808]], [[Joseph Louis Gay-Lussac]] mangertosi karakteristik [[gas]] sakpunika sami. Adédasar ing tèori saking [[John Dalton]], [[Joseph Proust]] saha ngerembakaken [[hukum perbandingan tetap]]ingkang badhe dados konsèp wiwit saking [[stoikiometri]] saha [[persamaan reaksi]].<ref>Brock, pp. 104–107</ref> |
Ing taun[[ 1808]], [[Joseph Louis Gay-Lussac]] mangertosi karakteristik [[gas]] sakpunika sami. Adédasar ing tèori saking [[John Dalton]], [[Joseph Proust]] saha ngerembakaken [[hukum perbandingan tetap]]ingkang badhe dados konsèp wiwit saking [[stoikiometri]] saha [[persamaan reaksi]].<ref>Brock, pp. 104–107</ref> |
||
== Saminipun == |
== Saminipun == |
||
[[Persamaan rèaksi]] dipunginakakén kanggè rèaksi kimia. |
[[Persamaan rèaksi]] dipunginakakén kanggè rèaksi kimia. Sami rèaksi saking [[rumus kimia]] utawi [[rumus struktur]] saking rèaktan sisih kiwa lan produk ing sisih téngèn. Antawis[[ produk]] lan [[rèaktan]] dipunpisahakén kaliyan pratitis(→) ingkang nunjukakè arah lan tipé rèaksi. Ujung saking pratanda kasébut nuduhake rèaksi owah saking arah pundhi. Pratitis panah ganda ({{eqm}}), ingkang gadahi kalih ujung tanda panah ingkang béntèn arahipun, diginakakè ing [[rèaksi kéetimbangan]]. Saminipun kimia kédhahipun séimbang, jumbuh kaliyan [[stoikiometri]], jumlah [[atom]] sabén unsur ing sisih kiwa kédhah sami kaliyan jumlah [[atom]] sabén unsur ing sisih téngén. Pényéimbangan ménika dipunlampahi supadas nambah angka ing ngajéng [[molèkul senyawa]] (dipunlambangaken kaliyan ''A, B, C'' dan ''D'' dipundiagramaken skèma ing ngandap) kaliyan angka alit (''a, b, c'' dan ''d'') ing ngajengipun.<ref>{{GoldBookRef|title=chemical reaction equation|file=C01034}}</ref> |
||
:<math>\mathrm{a\ A + b\ B \longrightarrow c\ C + d\ D}</math> |
:<math>\mathrm{a\ A + b\ B \longrightarrow c\ C + d\ D}</math> |
||
Révisi kala 19 Oktober 2013 10.40


Réaksi kimia inggih punika prosés alam ingkang asring ngasilakén ewahan Senyawa Kimia.[1]Sényawa utawi sényawa-sényawa wiwit ingkang gégayutan ing réaksi sagéd dipunsébapaken dados réaktan. Réaksi kimia dipunkaraktérisasikakén kaliyan Pérubahan kimiawi, lan badhè ngasilakén sétunggal utawi langkung produk ingkang nggadahi titikan ingkang bèntén saking réaktan. Sécara klasik, réaksi kimia ngayutakén kaewahan pérgérakan Èlèktron ing pémbéntukan lan pémutusan ikatan kimia, ménawi konsèp umum réaksi kimia ugi sagéd dipuntérapakè ing transformasi partikel-partikel elementer sami kaliyan reaksi nuklir. Reaksi-reaksi kimia ingkang panggenanipun dipunginakaken sami ing sintesis kimia kanggé ngasilakné produk senyawa ingkang sampun dados ancasipun. Ing salébéting biokimia reaksi kimia dipunkatalisis kaliyan enzim mbéntuk lintasan métabolismé, ing sintesèis saha dekomposisi ingkang biasanipun botén kédadosan ing sèl
Séjarah


Rèaksi kimia kadasta pembakaran, férméntasi, lan rèduksi saking bijih dados logam sampun dipunmangértosi jaman rumiyèn.Téori-téori wiwit transformasi saking matérial-matérial punika dirémbakaké dèning filsuf Yunani Kina, kadas Èlèmèn klasik saking Empedocles ingkang ngendika ménawi substansi kèmawon kasusun saking èlèmèn dasar inggih punika : Lati,toya, udara, lan [[bu.ing abad perètengahan, transformasi kimia dipunsinauni dèning para alkemis. Sédaya nyobi, tuladhanipun, ngubah timbal dados émas, kaliyan ngèrèaksiakén timbal kaliyan campuran témbaga timbal kaliyan sulfur.[2] Produksi saking sényawa-sényawa kimia ingkang botén wontén sécara alami ing donya, sampun lami para ilmuan, kados sintèsis saking asam sulfur lan asam nitrat saking alkemis Jābir ibn Hayyān. Prosès punika dipunlampahi kanthi cara béntérakèn minéral-minéral sulfat, saha nitrat, kados témbaga sulfat, alum lan kalium nitrat. Ing abad ke-17, Johann Rudolph Glauber mroduksi asam klorida lan natrium sulfat kaliyan ngréaksiakén asam sulfat kaliyan natrium klorida. Wontén ananè parémbagan lead chamber process ing taun 1746 lan prosès Leblanc, pramila ménawi wontén asam sulfat lan natrium karbonat ing jumlah agéng, mila rèaksi kimia sagéd dipun aplikasikakén ing industri. Tèknologi asam sulfat sampun majéng, pungkasaning sagéd ngasilakén prosès kontak ing taun 1880-an,[3] lan proses Haber dipunembagagen ing taun 1909–1910 kangge sintesis amonia.[4] Saking abad 16 peneliti kayadene Jan Baptist van Helmont, Robert Boyle saha Isaac Newtonnyobi kanggè némtuakén tèori-tèori saking transformasi-transformasi kimia ingkang sampun dipuneksperimenaken ing Tèori plogiston dipuncetusaken ing taun 1667 dèning Johann Joachim Becher. Téori punika mempostulataken ananè èlèmèn kayadènè lati ingkang sagéd dipunwastani "plogiston", ing salébéting benda-benda ingkang sagét kabakar saha dipunuwalakén ngantas pembakaran. Teori punika dipunbuktiaken luput ing taun 1785 dèning Antoine Lavoisier, ing pungkasan nyukani pangèrtosan ingkang lérés babakan pembakaran.[5] Ing taun1808, Joseph Louis Gay-Lussac mangertosi karakteristik gas sakpunika sami. Adédasar ing tèori saking John Dalton, Joseph Proust saha ngerembakaken hukum perbandingan tetapingkang badhe dados konsèp wiwit saking stoikiometri saha persamaan reaksi.[6]
Saminipun
Persamaan rèaksi dipunginakakén kanggè rèaksi kimia. Sami rèaksi saking rumus kimia utawi rumus struktur saking rèaktan sisih kiwa lan produk ing sisih téngèn. Antawisproduk lan rèaktan dipunpisahakén kaliyan pratitis(→) ingkang nunjukakè arah lan tipé rèaksi. Ujung saking pratanda kasébut nuduhake rèaksi owah saking arah pundhi. Pratitis panah ganda (Cithakan:Eqm), ingkang gadahi kalih ujung tanda panah ingkang béntèn arahipun, diginakakè ing rèaksi kéetimbangan. Saminipun kimia kédhahipun séimbang, jumbuh kaliyan stoikiometri, jumlah atom sabén unsur ing sisih kiwa kédhah sami kaliyan jumlah atom sabén unsur ing sisih téngén. Pényéimbangan ménika dipunlampahi supadas nambah angka ing ngajéng molèkul senyawa (dipunlambangaken kaliyan A, B, C dan D dipundiagramaken skèma ing ngandap) kaliyan angka alit (a, b, c dan d) ing ngajengipun.[7]

Rèaksi ingkang langkung rumit dipungambaraken kaliyan skèma réaksi, ancasipun kanggè mangertosi sényawa wiwit utawi pungkasan, utawi ugi nunjukakén fasé transisi. Pintén-pintén rèaksi kimia ugi sagéd dipuntambahakén sératan ing inggil tanda panah, tuladhanipu penambahan toya, béntèr, iluminasi, katalisasi, ugi pintén-pintén produk minor sagéd dipunpanggénakén ing ngandap panah.

Analisis rétrosintetik sagéd diginaakèn kanggè désain rèaksi sintèsis komplèks. Analisis dipunwiwiti saking produk, tuladhanipun mécah ikatan kimia ingkang kapilih dados reagen ènggal. Tanda panah khusus (⇒) diginakakén ing réaksi rètro.[8]
Rèaksi Èlèmèntèr
Rèaksi Èlèmèntèr inggih punika pemecahan sederhana lan asil saking rèaksi punika botén gadahi produk sampingan..[9] Katah rèaksi ingkang kasilipun dipunpanggihaken inggih punika ngérémbag saking rèaksi Èlèmèntèr ingkang tuwuh secara paralèl tuwin runtut. Sebuah rèaksi Èlèmèntèr saking pintén-pintén.[10]
- Disoasi dari molekul AB menjadi fragmen A dan B
Ing reaksi bimolekular, 2 molekul badhe bertabreakan lan saling bereaksi. kasil reaksinipun dipunasmani sintesis kimia utawa reaksi adisi.
Kemungkinan reaksi ingkang sanes inggih punika bagian saking sebuah molekul gantos ing sanesipun. Reaksi tipe kadasta punika, tuladhane inggih punika reaksi redoks lan reaksi asam-basa. Ing reaksi redoks partikel ingkang gantos inggih punika elektron, ananging ing reaksi asam-basa ingkang gantos proton. Reaksi kadasta punika ugi dipunsebat kaliyan reaksi metatesis.
contohnya
Termodinamika
Reaksi kimia saged dipunpanggihaken dening hukum-hukum termodinamika. Reaksi saged kedadosan kaliyan piyambakipun menawi senyawa kasebut eksergonik utawi nguwalaken energi. Energi bebas ingkang dipunkasilaken reaksi punika kaperang saking 2 besaran termodinamika inggih punika entalpi lan entropi]]:[11]
- G: energi bebas, H: entalpi, T: suhu, S: entropi, Δ: perbedaan
Reaksi eksotermik kedadosan menawi ΔH nggadahi nilai negatif lan energi dipunuwalaken. Tuladhaipun reaksi eksotermik inggih punika presipitasi lan kawalikanipun , salebeting reaksi endotermik, benter dipunpendet saking lingkungan. Sak punika saged dipunlampahi kaliyan ningkataken entropi sistem. amargi kenaikan entropi bandinganipun lurus kaliyan ingkang mboten kasunyatan , katah reaksi eksotermik dipunlampahi ing suhu ingkang rendah. Perubahan temperatur menika saged ngewahi arah reaksi, kadasta tuladha ing reaksi Boudouard:
Reaksi antawis karbon dioksida lan karbon kangge mbentuk karbon monoksida menika reaksi endotermik kalian suhu ing inggil 800 °C lan dados reaksi eksotermik mila suhunipun ing ngandap punika [12]
Reaksi ugi saged ngelampahi saged ningali lan ugi saged dipunmangertosi kaliyan energi dalam ingkang nyebataken kauwalan ing entropi, volume, lan potensial kimia.[13]
- U: energi ing, S: entropi, p: tekanan, μ: po]tensial kimia, n: jumlah molekul, d: tanda ingkang tegesipun kaewahan alit
Pengelompokan Reaksi Kimia
Aneka warni reaksi-reaksi kimia lan pendekatan-pendekatanipun ingkang dipunlampahi ing pasinaon ngakibataken katah cara kangge klasifikasiaken reaksi-reaksi kasebut, ingkang asring tumpang tindih. ing ngandap punika tuladha-tuladha klasifikasi reaksi kimia ingkang biasanipun dipunginaaken .
Sekawan reaksi dasar
Sintesis
Ing reaksi kombinasi langsung utawi sintesis, kalih utawi langkung senyawa sederhana gegayutan mbentuk senyawa enggal ingkang langkung kompleks. Kalih reaktan utawi langkung ingkang bereaksi nghasilaken setunggal produk ugi menika salah satunggaling cara kangge mangertosi menawi reaksi sintesis. Tuladha saking reaksi menika inggih punika gas hidrogen gegayutan kaliyan gas oksigen ingkang kasilipun inggih punika toya .[14]
Tuladha sanes inggih punika gas nitrogen gegayutan kaliyan gas hidrogen badhe mbentuk amoniak, kaliyan sami reaksi:
Dekomposisisi
Reaksi dekomposisi utawi analisis inggih punika ingkang mboten kasunyatan saking reaksi sintesis. Sebuah senyawa ingkang langkung kompleks badhe dipunpecah dados senyawa ingkang langkung sederhana.[14][15] Tuladhanipun inggih punika molekul toya ingkang dipunpecah dados gas oksigen lan gas hidrogen, kaliyan sami reaksi:
Panggantosan tunggal
Ing reaksi penggantian tunggal utawi substitusi, sebuah elemen tunggal gantosaken elemen tunggal sanesipun ing suatu senyawa. Tuladhanipun inggih punika logam natrium ingkang bereaksi kaliyan asam klorida badhe ngasilaken natrium klorida utawi uyah dapur, kaliyan persamaaan reaksi:
Pangertosan ganda
Ing reaksi pargantosan ganda, kalih senyawa menika gantos ion utawi ikatan kangge mbentuk senyawa enggal ingkang benten.[14] punika kedadosan ing wanci kation lan anion saking 2 senyawa ingkang benten saling gantos panggenan, lan mbentuk kalih senyawa enggal .[15] Rumus umum saking reaksi punika inggih punika:
- AB + CD → AD + CB
Tuladha saking reaksi gantosan ganda inggih punika timbal(II) nitrat bereaksi kaliyan kalium iodida kangge mbentuk timbal(II) iodida lan kalium nitrat, kaliyan sami reaksi:
- Pb(NO3)2 + 2 KI → PbI2 + 2 KNO3
Tuladha sanes inggih punika natrium klorida (uyah dapur) bereaksi kaliyan perak nitrat mbentuk natrium nitrat lan perak klorida, kaliyan persamaan reaksi:
Oksidasi dan reduksi
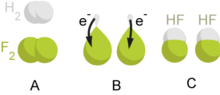
Reaksi redoks saged dipunpahami dados transfer elektron saking salah satunggaling senyawa (dipunsebat reduktor) ing senyawa sanesipun (dipunsebat oksidator). Ing proses punika, senyawa ingkang setunggal badhe teroksidasi lan senyawa sanesipun badhe tereduksi, amargi punika kasebut redoks. Oksidasi piyambak dipunmangertosi dados kenaikan bilangan oksidasi, lan reduksi inggih punika penurunan bilangan oksidasi. ing praktekipun , transfer saking elektron punika badhe ngewahi wilangan oksidasinipun, ananging katah reaksi ingkang dipunklasifikasiaken dados reaksi redoks menawi sejatosipun mboten wonten elektron ingkang gantos (kadasta ingkang gayutaken ikatan kovalen).[16][17] Tuladha reaksi redoks inggih punika:
- 2 S2O32−(aq) + I2(aq) → S4O62−(aq) + 2 I−(aq)
- Yang mana I2 dipunreduksi dados I- lan S2O32- (anion tiosulfat) dipunoksidasi dados S4O62-.
Kangge mangertosi reaktan pundhi ingkang badhe dados agen pereduksi lan pundhi ingkang badhe dados agen teroksidasi saged dipunmangertosi saking keelektronegatifan elemen kasebut. Elemen ingkang nggadahi nilai keelektronegatifan ingkang rendah, kadasta katah unsur logam, mila badhe gampil maringi elektron menika lan teroksidasi - elemen punika dados reduktor. sakwalike, katah ion ngadahi bilangan oksidasi inggil, kadasta H2O2, MnO4-, CrO3, Cr2O72-, OsO4) saged pikoleh satu utawi langkung tambahan elektron, ngantos dipunsebat oksidator. Jumlah elektron ingkang dipunparingake utawi dipuntampi ing reaksi redoks saged dipunmangertosi saking konfigurasi elektronn elemen reaktanipun. Saben elemen badhe usaha kangge dadosaken konfigurasi elektronipun sami kaliyan konfigurasi elemen gas mulia. Logam alkali lan halogen badhe maringi lan nampi setunggal elektron. Elemen gas alam piyambak sejatosipun mboten aktif secara kimiawi.[18]
Salah satunggaling bagian ingkang wigatos ing reaksi redoks inggih punika reaksi elektrokimia, ing pundhi elektron saking sumber listrik dipung reduktor. ingkang dados Reaksi punika wigati sedaya kangge ndamel elemen-elemen kimia, kadasta klorin[19] utawi aluminium. Proses reaksi redok mboten kasunyatan ing pundhi dipunginaaken kangge ngasilaken listrik ugi mboten lan prinsip punika dipunginaaken ing baterai.
Reaksi asam-basa
Reaksi asam-basa inggih punika reaksi ingkang ndonoraken proton saking sebuah molekul asam ing molekul basa. Ing ngriki, asam gadahi peran dados donor proton lan basa gadahi peran dados akseptor proton.
- Reaksi asam basa, HA: asam, B: Basa, A–: basa konjugasi, HB+: asam konjugasi
Kasil sangking transfer proton punika yaiku asam konjugasi lan basa konjugasi.[20] Reaksi kesetimbangan (bolak-balik) ugi wonten, lan amargi punika asam utawi basa lan asam utawi basa konjugasinipun menika wonten ing kesetimbanganipun. Reaksi kesetimbangan punika dipuntitiki kaliyan wontenipun konstanta diasosiasi asam lan basa (Ka dan Kb) saking saben substansinipun. Sebuah reaksi ingkang mliginipun saking reaksi asam-basa inggih punika netralisasi ing pundhi asam lan basa ing jumlah ingkang sami badhe mbentuk garam ingkang asifat netral. Reaksi asam basa gadahi pinten-pinten definisi gumantung ing konsep asam basa ingkang dipunginaaken. Pinten-pinten definisi ingkang paling umum inggih punika:
- Definisi Arrhenius: asam berdisosiasi ing toya ngelepasaken ion H3O+; basa berdisosiasi ing toya ngelepasaken ion OH-.
- Definisi Brønsted-Lowry: Asam inggih punika pendonor proton (H+) donors; basa inggih punika nampi (akseptor) proton. anglingkupi definisi Arrhenius
- Definisi Lewis: Asam inggih punika akseptor pasangan elektron; basa inggih punika pendonor pasangan elektron. Definisi punika anglingkupi definisi Brønsted-Lowry.
Presipitasi
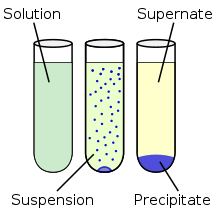
Presipitasi inggih punika proses reaksi kabentuk padatan (endapan) ing salebeting sebuah larutan dados kasil saking reaksi kimia. Presipitasi punika biasanipun kabentuk ing konsentrasi ion ingkang larut sampun gayuh wates kelarutan[21] lan kasilipun inggih punika mbentuk garam. Reaksi punika saged dipuncepetake menawi nambahaken agen presipitasi utawi ngirangi pelarutnipun. Reaksi presipitasi menika ingkang ngasilaken residu mikrokristalin lan proses ingkang lambat badhe ngasilaken kristal tunggal. Kristal tunggal ugi saged pikoleh saking rekristalisasi saking garam mikrokristalin.[22]
Reaksi ing Zat Padat
Reaksi saged kedadosan ing antawisipun kalih benda padat. ananging mekaten, amargi tingkat difusi ing zat padat sanget rendah, mila reaksi kimia ingkang kalangsungaken dados sangat lambat. Reaksi saged dipuncepetake kaliyan cara ningkataken suhu pramila badhe mecah reaktan, pramila ombo permukaan kontak dados langkung ageng.[23]
Reaksi fotokimia

Ingreaksi fotokimia, atom lan molekul badhe nyerap energi (foton) saking cahya lan gayutaken ingeksitasi. Atom lan molekul punika lajeng saged ngelepasake energi kaliyan mecahake ikatan kimia, mila ngasilaken radikal. Reaksi ingkang kalebet ing reaksi fotokimia ing natawisipun reaksi hidrogen-oksigen, polimerisasi radikal, reaksi berantai lan reaksi penataan ulang.[24] Katah proses-proses ingkang wigati ginaaken fotokimia. Tuladha ingkangg paling umum inggih punika fotosintesis, ing pundhi taneman ginaaken energi matahari kangge ngubah karbon dioksida lan toya dados glukosa lan oksigen dados kasil sampingan. Manungsa ngandalaken fotokimia ing pembentukan vitamin D, lan persepsi visual dipunkasilaken saking reaksi fotokimia ing rhodopsin.[25] Ing kunang-kunang, sebuah enzim ing abdomen ngkatalisasi reaksi ingkang ngasilaken bioluminesensi.[26] Katah reaksi fotokimia, kadasta pembentukan ozon, kedadosan ing atmosfer bumi ingkang angliputi bagian saking kimia atmosfer.
Katalisis

Ing katalisis, reaksinipun mboten kalangsungan secara spontan, ananging ngelampahi substansi ketiga ingkang dipunsebat kaliyan katalis. Mboten kadasta reagen sanesipun ingkang nderek ing reaksi kimia, katalis mboten nderek serta ing reaksi punika piyambak, ananging saged nghambat, matikan, utawi nghancuraken ngelampahi proses sekunder. Katalis saged dipunginaaken ing fase ingkang benten-benten (katalis heterogen) utawi ing fase ingkang sami (katalis homogen) dados reaktan. Fungsi katalis namung mempercepat reaksi - zat kimia ingkang ngelambataken reaksi dipunsebat kaliyan inhibitor.[27][28] Substansi yang meningkatkan aktivitas katalis dipunsebat promoter, lan substansi ingkang mematikan katalis dipunsebat racun katalis. Sebuah reaksi kimia ingkang sejatosipun mboten kalangsungan amargi energi aktivasinipun langkung inggil , saged dados kalangsungan amargi wonten katalis punika. Katalis heterogen biasanipun padat lan bentuk bubuk supados saged maksimalaken luas permukaan ingkang bereaksi. Zat-zat ingkang wigati ing katalisis heterogen ing antawisipun logam-logam grup platinum lan logam transisi sanesipun. Zat-zat punika biasanipun dipunginaaken ing hidrogenasi, pembentukan katalitik lan sintesis saking senyawa-senyawa kimia kadasta asam nitrat lan amonia. Asam inggih punika tuladha saking katalis homogen, menika ningkataken nukleofilitas saking karbonil. Kalangkungan saking katalis homogen inggih punika gampil kangge dipuncampurake kaliyan reaktanipun, ananging kekiranganipun anggel anggene dipunpisahake saking produk pungkasanipun. Mekawi mekate, katalis heterogen langkung dipunpilih katah proses industri.[29]
Reaksi ingm kimia organik
Ing kimia organik, katah reaksi ingkang saged kedadosan ingkang ngelibataken ikatan kovalen ing antawisipun atom karbon lan heteroatom sanesipun kadasta oksigen, nitrogen, utawi atom-atom halogen sanesipun. Pinten-pinten reaksi ingkang langkung spesifik badhe njelentrehake ing ngandap punika .
Substitusi
Ing reaksi substitusi, sebuah gugus fungsi ing salebeting senyawa kimia dipungantosaken kaliyan gugus fungsi sanesipun.[30] Reaksi punika saged dipunbentenaken ugi dados pinten-pinten subtipe inggih punika nukleofilik, substitusi elektrofilik, utawi substitusi radikal. direction = vertical | image1 = SN1 reaction mechanism.png|width1 = 300|image2 = SN2 reaction mechanism.png|width2 = 300| caption1 = SN1 mechanism| caption2 = SN2 mechanism Ing tipe ingkang kawiwitan, nukleofil, atom utawi molekul ingkang gadahi kalangkungan elektron pramila bermuatan negatif, badhe gantosaken atom sanesipun utawi bagian sanesipun saking molekul "substrat". Pasangan elektron nukleofil badhe nyatu kaliyan substrat mbentuk ikatan enggal, ananging gugus lepas badhe nglepas sami kaliyan sebuah pasangan elektron. Nukleofil saged bermuatan netral utawi positif, ananging substrat biasanipun bermuatan positif utawi netral. Tuladhane nukleofil inggih punika ion hidroksida, alkoksida, amina, lan halida. Reaksi semacem punika biasanipun dipuntemuaken ing hidrokarbon alifatik lan mboten dipuntemtuaken ing hidrokarbon aromatik. Hidrokarbon aromatik gadahi rapatan elektron inggal lan ngantos saged kalangsungan substitusi aromatik nukleofilik namung kaliyan gugus penarik elektron ingkang sangat kiat. Substitusi nukleofilik saged kalangsungan ngelampahi 2 mekanisme, Reaksi SN1 lan SN2. Miturut asmanipun, S cekakan saking substitusi, N singkatan dai nukleofilik, lan, angka nunjukaken ordo kinetik reaksi, unimolekuler utawi bimolekuler.[31]
Reaksi SN1 kalangsungan ing kalih tahap. Tahap kawiwitan, gugus lepas badhe ngelepas lan mbentuk karbokation. Tahap punika badhe dipundereaken reaksi ingkang sanget cepet kaliyan nukleofil.[32] Ing mekanisme SN2, nukleofil badhe mbentuk tahap transisi kaliyan molekul ingkang uwal lan namung terlekang. Kalih mekanisme punika benten-benten ing kasil stereokimianipun. Reaksi SN1 ngasilaken adisi non-stereospesifik lan mboten ngasilaken pusat chiral, ananging ing bentuk isomer geometri (cis/trans). kawalikane, inversi Warden- punika ingkang dipunamati ing mekanisme SN2.[33] Substitusi elektrofilik menika kawalikan saking substitusi nukleofilik ing pundhi atom utawi molekul ingkang ngelepas, utawi elektrofilnipun, gadahi kerepetan elektron ingkang rendah ngantos bermuatan positif. Biasanipun elektrofil punika atom karbon saking gugus karbonil, karbokation utawi sulfur utawi kation nitronium. Reaksi punika kalangsungan ing hidrokarbon aromatik kemawon, pramila dipunsebat substitusi aromatik elektrofilik. Serangan elektrofil badhe nyiptaaken kompleks ingkang dipunsebat dados σ-compleks, sebuah fase transisi ing pundhi sistem aromatikipun ical . lajeng, gugus lepas (biasanipun proton), badhe kapisah lan sifat kearomatikipun balik . Alternatif sanes kangge substitusi aromatik inggih punika substitusi alifatik elektrofilik. Substitusi punika sami kaliyan substitusi aromatik elektrofilik lan ugi gadahi kalih tipe utami inggih punika SE1 lan SE2[34]

Adisi lan eliminasi
Adisi lan pasanganipu eliminasi menika reaksi ingkang ngubah jumlah substituen ing atom karbon, lan mbentuk ikatan kovalen. Ikatan ganda lan tiga saged kaasilaken kaliyan mengeliminasi gugus lepas ingkang jumbuh. Kadasta substitusi nukleofilik, wonten pinten-pinten mekanisme reaksi ingkang kedadosan. Ing mekanisme E1, gugus lepas kalangkungan rumiyen ngelepas lan mbentuk karbokation. Saklajengipun, mbentuk ikatan ganda kedadosan ngelampahi eliminasi proton (deprotonasi). Dalam mekanisme E1cb, urutan pelepasan terbalik: proton dieliminasi terlebih dahulu. Dalam mekanisme punika ngelibataken suatu basa kedhah wonten.[35] Reaksi ing eliminasi E1 utawi E1cb menika bersaing kaliyan substitusi SN1 amagi gadahi kahanan reaksi kondisi ingkang sami.[36]

Mekanisme E2 ugi mbetahaken basa. ananging, gantos panggenan basa lan eliminasi gugus uwal ingkang kalangsungan secara serentak lan mboten ngasilaken zat antawisipun ionik. Benten kaliyan eliminasi E1, konfigurasi stereokimia ingkang benten saged dipunkasilaken ing reaksi ingkang gadahi mekanisme E2 amargi basa badhe langkung memfavoritkan eleminasi proton ingkang wonten ing panggenan-anti kaliyan gugus uwal. Amargi kahanan lan reagen reaksi ingkang sami , eliminasi E2 menika bersaing dengan substitusi SN2.[37]

Kawalikan saking reaksi eliminasi inggih punika reaksi adisi. Ing reaksi adisi, ikatan rangkep kalih utawi rangkap tiga dipunubah dados ikatan rangkap tunggal. Sami kaliyan reaksi substitusi, wonten pinten-pinten tipe saking adisiingkang dipunbentenaken saking partikel ingkang ngadisi. Tuladhanipun, ing adisi elektrofilik hidrogen bromida, sebuah elektrofil (proton) badhe gantos ikatan rangkep ganda lan mbentuk karbokation, lajeng ngereaksi kaliyan nukleofil (bromin). Karbokation saged kabentuk ing salah satunggaling ikatan rangkep gumantung saking gugus ingkang ngeleket ing pungkasan . Konfigurasi ingkang langkung trep saged dipunprediksiaken kaliyan aturan Markovnikov.[38] Aturan Markovnikov ngendikan: "Ing adisi heterolitik saking sebuah molekul polar ing alkena utawi alkuna, atom ingkang gadahi keelektronegatifan ingkang ageng, mila badhe kaiket ing atom karbon ingkang ngikat atom hidrogen ingkang langkung kedhik."[39]
Reaksi kimia organik sanesipun

Ing reaksi penataan ulang, kerangka karbon saking sebuah molekul dipunsusun malih pramila mbentuk isomer struktur saking molekul aslinipun. Reaksi punika kalebet [reaksi sigmatropik]] kadasta penataan ulang Wagner-Meerwein, ing pundhi gugus hidrogen, alkil, utawi aril gantos-gantos panggenan saking suatu atom karbon ing atom karbon sanesipun. Katah reaksi penataan malih inggih punika pemutusan lan pambentukan ikatan karbon-karbon enggal. Tuladha sanes saking reaksi punika yaiku penataan ulang cope. [40]
Reaksi sanesipun
- Isomerisasi, ing senyawa kimia ngelampahi penataan malih struktur tanpa kauwahan ing komposisi atomipun
- Pembakaran, inggih punika sejenis reaksi redoks ingkang bahan-bahanipun ingkang saged kabakar gegayutan kaliyan unsur-unsur oksidator, biasanipun oksigen, kange ngasilaken benter lan mbentuk produk ingkang teroksidasi. Istilah pembakaran biasanipun dipunginaaken kangge ngerujuk namung ing oksidasi skala ageng ing sedaya molekul. Oksidasi terkontrol namung ing setunggal gugus fungsi tunggal mboten kalebet ing proses pembakaran.
- Disproporsionasi, kaliyan setunggal reaktan mbentuk kalih jenis produk ingkang benten namung ing kahanan oksidasinipun.
- 2 Sn2+ → Sn + Sn4+
Kinetika kimia
Laju reaksi suatu reaksi kimia menika pengukuran konsentrasi utawi tekanan zat-zat ingkang gegayutan ing reaksi kauwah ing kalampahan wekdal. Analisis laju reaksi menika wigati lan gadahi katah mupangatipun , tuladhane ing teknik kimia lan kajian kesetimbangan kimia. Lajeng reaksi secara ndasar ngumantung ing:
- Konsentrasi reaktan, ingkang biasanipun ndamel reaksi kalampahan kaliyan langkung cepet menawi konsentrasinipun dipununggahake . menika amargi peningkatan pertumbukan atom per satuan wekdal,
- Luas permukaan ingkang kasedia kangge reaktan kangge saling berinteraksi, utaminipun reaktan padet ing sistem heterogen. Ombo permukaan ingkang ageng badhe ningkataken laju reaksi.
- Tekanan, kaliyan ningkataken tekanan, menika nurunaken volume antawis molekul pramila badhe ningkataken frekuensi tumbukan molekul.
- Energi aktivasi, ingkang dipundefinisiaken dados jumlah energi ingkang dipunbetahaken kangge ndamel reaksi kawiwitan lan berjalan secara spontan. Energi aktivasi ingkang langkung inggil ngimplikasiaken menawi reaktan menika langkung mbetahaken katah kangge kawiwitan reaksi menawi reaksi ingkang berenergi aktivasi langkung rendah.
- Temperatur, ingkang ningkataken laju reaksi menawi dipunnaikaken, punika amargi temperatur ingkang inggil ningkaatken energi molekul, pramila ningkataken tumbukan antawis molekul per satuan wakdal.
- Panggenan utawi ketiadaan katalis. Katalis inggih punika zat ingkang ngubah lintasan (mekanisme) suatu reaksi lan badhe ningkataken laju reaksi kaliyan nurunaken energi aktivasi ingkang dipunbetahaken supados reaksi saged kalampahan. Katalis mboten dipunkonsumsi utawi kaewah selama reaksi, pramila menika saged dipunginaaken malih .
- Kangge pinten-pinten reaksi, keberadaan radiasi elektromagnetik, utamanipun ultraviolet, dipunmbetahaken kangge mutusaken ikatan ingkang dipunbetahaken supados reaksi saged mulai. Utaminipun kedadosan ing reaksi ingkang ngelibataken radikal.
Laju reaksi gegayutan kaliyan konsentrasi zat-zat ingkang gegayutan ing reaksi. Gegayutan punika dipuntemtuaken dening persamaan laju saben reaksi. Kedhah dipungatosaken menawi pinten-pinten reaksi gadahi kelajuan ingkang mboten gumantung ing konsentrasi reaksi. punika dipunsebat dados reaksi orde nol.
Reaksi biokimia

Reaksi biokimia ing umumipun dipunkendaliaken dening enzim. Protein-protein punika namung saged mengkatalis setunggal jenis reaksi ingkang spesifik, pramila reaksinipun menika saged dipunkontrol. Reaksi punika kalangsungan ing sisi aktif saking substrat. Reaksi katalisasi enzim punika gumantung ing katah prekawis , ing antawisipun inggih punika bentuk enzimipun, jenis iketanipun, interaksi elektrostatik, kaawehan lan panampi proton (ing reaksi asam utawi basa), lan sanesipun. [41] Reaksi kimia ingkang kalangsungan ing salebeti salira makhluk urip biasanipun ugu dipuntepang kaliyan sebatan metabolisme. Ing antawisipun sedaya reaksi-reaksi punika, reaksi ingkang wigatos inggih punika reaksi anabolisme, ing pundhi DNA lan enzim-terkontrol memproses pembentukan protein lan karbohidrat saking senyawa-senyawa ingkang langkung alit.[42] Bioenergitika nyinaoni sumber energi kangge reaksi biokimia. Sumber energi ingkang wigati ing reaksi punika glukosa, ingkang dipunproduksi taneman ngelampahi proses fotosintesis. Sedaya organisme mbetahaken glukosa kangge memproduksi adenosin trifosfat (ATP), ingkang dipunginaaken makhlukurip kangge njalanaken aktivitaipun.
Penggunaan reaksi kimia

Reaksi kimia menika asring dipunginaaken dening para ahli teknik kimia kangge mensintesis senyawa enggal saking sumber daya alam mentah ing alam, kadasta lenga bumi lan bijih-bijih mineral. menika ingkang wigati kangge ndamel reaksi ingkang seefisien , memaksimalkan kasil ingkang saged pikoleh lan meminimalkan reagen ingkang dipunagem, energi mlebet lan energi medhal. Katalis biasanipun dipunginaaken kangge ngirangi energi aktivasi pramila ningkataken laju reaksinipun.[43][44] Pinten-pinten reaksi ingkang spesifik gadahi ginaaken ingkang mlipun. Tuladhane, reaksi termit dipundamel kangge nghasilaken surya lan benter ing piroteknik lan pengelasan. Menawi reaksi punika langkung anggel dipunkontrol menawi reakai-reaksi sakderengipun, ananging alat-alat ingkang dipunbetahaken tebih langkung kedhik lan ngantos punika tasih dipunginaaken kangge ngowahi jalur-jalur kereta api ing panggenan terpelosok.[45]
Ndelengen uga
- Reaksi organik
- Reaksi kimia anorganik
- Stoikiometri
- Teori keadaan transisi
- Stoikiometri gas
- Reaksi autokatalitik
- Coefficients
- Q values
- Reaksi endoterm
- Reaksi eksoterm
Cathetan Suku
- ↑ (ing basa Indonésia)[GoldBookRef|title=chemical reaction|file=C01033 Pengertian Reaksi Kimia](dipununduh Tanggal 30 September 2012)
- ↑ (ing basa Indonésia)[cite journal|last1=Weyer|first1=Jost|title=Neuere Interpretationsmglichkeiten der Alchemie|volume=7|pages=177|journal=Chemie in unserer Zeit|language=German|year=1973|doi=10.1002/ciuz.19730070604|issue=6 Sejarah Reaksi Kimia] (dipununduh Tanggal 30 September)
- ↑ (ing basa Indonésia)Leonard J. Friedman & Samantha J. Friedman The History of the Contact Sulfuric Acid Process, Acid Engineering & Consulting, Inc. Boca Raton, Florida] (dipununduh Tanggal 30 September 2012)
- ↑ John E. Lesch The German chemical industry in the twentieth century, Springer, 2000, ISBN 0-7923-6487-2 p. 170 Sejarah Reaksi Kimia]
- ↑ Brock, pp. 34–55
- ↑ Brock, pp. 104–107
- ↑ International Union of Pure and Applied Chemistry. "chemical reaction equation". Compendium of Chemical Terminology Internet edition.
- ↑ Corey, E. J. (1988). "Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples". Chemical Society Reviews. 17: 111. doi:10.1039/CS9881700111.
- ↑ International Union of Pure and Applied Chemistry. "elementary reaction". Compendium of Chemical Terminology Internet edition.
- ↑ Gernot Frenking: Elementarreaktionen. In: Römpp Chemie-Lexikon, Thieme, 2006
- ↑ Atkins, pp. 106–108
- ↑ Wiberg, pp. 810–811
- ↑ Atkins, p. 150
- ↑ a b c To react or not to react?. Utah State Office of Education. Retrieved 4 June 2011.
- ↑ a b Six Types of Chemical Reactions – MrGuch ChemFiesta.
- ↑ Christian B. Anfinsen Advances in protein chemistry, Academic Press, 1991 ISBN 0-12-034242-1 p. 7
- ↑ A. G. Sykes Advances in Inorganic Chemistry, Volume 36, Academic Press, 1991 ISBN 0-12-023636-2 p. 359
- ↑ Wiberg, pp. 289–290
- ↑ Wiberg, p. 409
- ↑ International Union of Pure and Applied Chemistry. "conjugate acid–base pair". Compendium of Chemical Terminology Internet edition.
- ↑ International Union of Pure and Applied Chemistry. "precipitation". Compendium of Chemical Terminology Internet edition.
- ↑ Jörg Wingender, Stefanie Ortanderl Ausfällung. In: Römpp Chemie-Lexikon., Thieme, July 2009
- ↑ Ralf Alsfasser, Erwin Riedel, C Janiak, HJ Meyer Modern Inorganic Chemistry. 3. Edition. de Gruyter, 2007, ISBN 978-3-11-019060-1, p. 171
- ↑ Atkins, pp. 937–950
- ↑ Christophe Dugave Cis-trans isomerization in biochemistry, Wiley-VCH, 2006 ISBN 3-527-31304-4 p. 56
- ↑ David Stanley Saunders Insect clocks, Elsevier, 2002, ISBN 0-444-50407-9 p. 179
- ↑ International Union of Pure and Applied Chemistry. "catalyst". Compendium of Chemical Terminology Internet edition.
- ↑ International Union of Pure and Applied Chemistry. "inhibitor". Compendium of Chemical Terminology Internet edition.
- ↑ Christoph Elschenbroich: Organometallchemie. 6th edition, Wiesbaden, 2008, ISBN 978-3-8351-0167-8, p. 263
- ↑ Cithakan:JerryMarch
- ↑ S. R. Hartshorn, Aliphatic Nucleophilic Substitution, Cambridge University Press, London, 1973. ISBN 0-521-09801-7 pp. 1 ff
- ↑ Leslie C. Bateman, Mervyn G. Church, Edward D. Hughes, Christopher K. Ingold and Nazeer Ahmed Taher (1940). "188. Mechanism of substitution at a saturated carbon atom. Part XXIII. A kinetic demonstration of the unimolecular solvolysis of alkyl halides. (Section E) a general discussion". Journal of the Chemical Society: 979. doi:10.1039/JR9400000979.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Brückner, pp. 63–77
- ↑ Brückner, pp. 203–206
- ↑ Brückner, hal. 192
- ↑ Brückner, hal. 183
- ↑ Brückner, hal. 172
- ↑ Wiberg, pp. 950, 1602
- ↑ International Union of Pure and Applied Chemistry. "Markownikoff rule". Compendium of Chemical Terminology Internet edition.
- ↑ Marye Anne Fox, James K. Whitesell Organic chemistry, 2004, ISBN 0-7637-2197-2 p. 699
- ↑ Peter Karlson , Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok. Karlson Biochemistry and Pathobiochemistry, 16th edition, Georg Thieme, 2005, ISBN 978-3-13-357815-8, pp. 55–56
- ↑ International Union of Pure and Applied Chemistry. "anabolism". Compendium of Chemical Terminology Internet edition.
- ↑ Gerhard Emig, Elias Klemm. Technical Chemistry. 5th edition, Springer, 2005, ISBN 978-3-540-23452-4, pp. 33–34
- ↑ Trost, B. (1991). "The atom economy—a search for synthetic efficiency". Science. 254 (5037): 1471. doi:10.1126/science.1962206. PMID 1962206.
- ↑ John J. McKetta, Guy E Weismantel Encyclopedia of Chemical Processing and Design: Volume 67 – Water and Wastewater Treatment: Protective Coating Systems to Zeolite, Volume 67, CRC Press, 1999 ISBN 0-8247-2618-9, p. 109












