Étanol: Béda antara owahan
Tanpa ringkesan besutan |
|||
| Larik 100: | Larik 100: | ||
[[Indeks refraksi]] etanol yaiku 1,36242 (ing ''λ''=589,3 nm dan 18,35 °C).<ref name="crc"/> |
[[Indeks refraksi]] etanol yaiku 1,36242 (ing ''λ''=589,3 nm dan 18,35 °C).<ref name="crc"/> |
||
== Sifat-sifat kimia == |
|||
{{detail|Alkohol}} |
|||
Etanol kalebu alkohol primer, kang tegesé bilih karbon uga talènan karo gugus hidroksil paling ora nduwèni atom hidrogen loro kang katalèn karo etanol. Rekasi kimia kang dilakokaké déning etanol akèh-akèhé ing sakupengé gugus hidroksilé. |
|||
=== Reaksi asam-basa === |
|||
Gugus hidroksil etanol nggawé molekul iki rada [[basa]]. Etanol mèh netral ing njero banyu, kanthi [[pH]] 100% etanol yaiku 7,33, berbandhing karo pH banyu murni kang gedhéné 7,00. Etanol bisa diowahi dadi [[konjugat basa]]né, ion [[alkoksida|etoksida]] (CH<sub>3</sub>CH<sub>2</sub>O<sup>−</sup>), kanthi ngreaksiké karo [[logam alkali]] kayata [[natrium]]: |
|||
:2CH<sub>3</sub>CH<sub>2</sub>OH + 2[[sodium|Na]] → 2CH<sub>3</sub>CH<sub>2</sub>ONa + [[hidrogen|H<sub>2</sub>]] |
|||
utawa karo basa kuat kaya [[natrium hidrida]]: |
|||
:CH<sub>3</sub>CH<sub>2</sub>OH + NaH → CH<sub>3</sub>CH<sub>2</sub>ONa + [[hidrogen|H<sub>2</sub>]]. |
|||
Reaksi kaya iki ora bisa dilakokaké ing larutan akuatik, amarga banyu luwih asam tinimbang etanol, saéngga kawentuké hidroksida luwih disenengi tinimbang kawentuké etoksida. |
|||
== Cathetan suku == |
== Cathetan suku == |
||
Révisi kala 28 Fèbruari 2013 11.33
Artikel iki lagi ingowahan gedhèn-gedhèn 28 Februari 2013 suwéné. Saperlu ngéndhani cengkah ing pambesut, panjenengan aja mbesut kaca iki nalika layang iki isih kapajang. Kaca iki pungkasan ingowahan nalika 11:33, 28 Fèbruari 2013 (UTC) (11 taun kapungkur). Panjenengan katuran mbusek cithakan iki yèn kaca iki wis ora kabesut ing dalem sawatara jam. Manawa panjenengan juru pambesut kang ngetrapaké cithakan iki, pesthèkaké panjenengan mbusek cithakan iki utawa nggantèni nganggo {{Lagi kagarap}} antarané mangsa anggoné panjenengan mbesut. |
| Étanol | |
|---|---|
 | |
 |
 |
Etanol | |
Jeneng liya Etil alkohol; hidroksietana; alkohol; etil hidrat; alkohol absolut | |
| Identifikasi | |
| Nomor CAS | [64-17-5] |
| PubChem | |
| Nomer RTECS | KQ6300000 |
| SMILES | CCO |
| InChI | 1/C2H6O/c1-2-3/h3H,2H2,1H3 |
| Sifat | |
| Rumus molekul | C2H5OH |
| Massa molar | 46,07 g/mol |
| Panampilan | cairan tak berwarna |
| Densitas | 0,789 g/cm3 |
| Titik leleh |
−114,3 |
| Titik umob |
78,4 |
| Kelarutan dalam air | tercampur penuh |
| Kaasaman (pKa) | 15,9 |
| Viskositas | 1,200 cP (20 °C) |
| Momen dipol | 1,69 D (gas) |
| Bahaya | |
| Klasifikasi EU | Mudah terbakar (F) |
| NFPA 704 | |
| Frasa-R | R11 |
| Frasa-S | Cithakan:S2 S7 S16 |
| Titik murub | 13 °C (55.4 °F) |
| Senyawa kagandhèng | |
| Senyawa kagandhèng | metanol, propanol |
| Kejaba ditélakaké suwaliké, data ing ndhuwur kanggo ing suhu lan tekanan standar (25°C, 100 kPa) | |
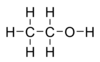
Etanol, diarani uga etil alkohol, alkohol murni, alkohol absolut, utawa alkohol, yaiku sejenis cairan kang gampang nguap, gampang kebakar, ora ana wernané lan minangka alkohol kang paling asring digunakaké ing padinan. Senyawa iki minangka obat psikoaktif lan bisa ditemokaké ing ombèn-ombèn kang ngandhut alkohol lan ing alat termometer modern. Etanol yaiku salah sawijiné obat rekreasi kang paling tuwa.
Etanol kalebu ing alkohol ranté tunggal, kanthi rumus kimia C2H5OH lan rumus empiris C2H6O. Etanol yaiku isomer konstitusional saka dimetil eter. Etanol asring dicekak dadi EtOH, kanthi "Et" minangka cekakan saka gugus etil (C2H5).
Fermentasi gula dadi etanol yaiku salah sawijiné reaksi organik paling wiwitan kang tau dilakokaké manungsa. Èfèk saka ngonsumsi etanol kang bisa nggawé mabuk uga wis dimangertèni wiwit biyèn. Ing jaman modern, etanol kang dituduhaké kanggo kagunan indhustri dikasilaké saka kasil sampingan pengilangan minyak bumi.[1]
Etanol akèh digunakaké minangka pelarut manéka werni bahan-bahan kimia kang dituduhaké kanggo konsumsi lan kagunan manungsa. Tuladhané yaiku ing minyak wangi, perasa, pewarna panganan, lan obat-obatan. Ing kimia, etanol yaiku pelarut kang wigati uga minangka stok umpan kanggo sintesis senyawa kimia liyané. Ing sujarahé, etanol wis suwé digunakaké kanggo bahan bakar.
Sujarah

Etanol wis digunakaké déning manungsa wiwit jaman prasejarah minangka bahan kang nggawé mabuk ing ombèn-ombèn kang ngandhut alkohol. Residu kang ditemokaké ing paninggalan keramik kang umuré 9000 taun saka Cina bagéyan lor nuduhaké bilih ombèn-ombèn alkohol wis digunakaké déning manungsa prasejarah saka jaman Neolitik.[2]
Etanol lan alkohol mbentuk larutan azeotrop. Mula pemurnia etanol kang ngandhut banyu kanthi cara penyulingan padatan mung bisa ngasilaké etanol kanthi kemurnia 96%. Etanol murni dikasilaké sepisanan ing taun 1976 dening Johan Tobias Lowitz, yaiku cara nyaring alkohol kasil destilasi lumantar areng.
Lavoisier nggambaraké bilih etanol yaiku senyawa kang kawentuk saka karbon, hidrogen, [[lan oksigen. Ing atun 1808, Saussure kasil nemtokaké rumus kimia etanol. Sèket taun sabanjuré (1858), Couper mublikasikaké rumus kimia etanol. Mula etanol yaiku salah sawijiné senyawa kimia kang kapisan ditemokaké rumus kimiané.[3]
Sepisanan, etanol digawé kanthi cara sintetik ing taun 1826 kanthi kapisah déning Henry hennel saka Britania Raya lan S.G Serullas saka Perancis. Ing taun 1828, Michael Faraday kasil nggawé etanol saka hidrasi etilena kang dikalisis déning asam. Prosès iki kaya prosès sintesis etanol indhustri modern.[4]
Etanol wis digunakaké minangka bahan bakar ing Amerika Serikatwiwit taun 1840. Nanging, pajek panggunaané ora ekonomis. Pajek iki dibusak ing taun 1906[5] lan wiwit taun 1908 otomobil Ford Model T wis bisa dilakokaké nggunakaké etanol.[6] Nanging, kanthi anané larangan ombènan kang ngandhut alkohol ing taun 1920, para bakul bahan bakar etanol didarani komplotan karo oenghasil ombènan alkohol kang ora resmi, lan bahan bakar etanol banjur ditinggalaké panggunaané nganti pungkasan abad 20.
Sifat-sifat fisika
| 275px | 275px | 275px |
| Volume kang luwih saka campuran etanol karo banyu (kontraksi volume) | Kalor pencampuran campuran etanol karo banyu | Kesetimbangan uap-cair campuran etanol karo banyu (kalebu uga azeotrop) |

|

|
|
| Kesetimbangan padhet-cair saka campuran etanol lan banyu (kalebu eutektikum) | Celah ketercampuran (miscibility gap) ing campuran dodekana lan etanol]] |
Etanol yaiku cairan kang ora ana wernané, gampang nguap kanthi ambu kang khas. Etanol kebakar tanpa abluk kanthi ilat geni awerna biru lan trakadhang ora bisa didelok ing cahaya kang padatan.
Sifat-sifat fisika etanol mliginé diéprabawani déning anané gugus hidroksil lan cekaké ranté karbon etanol. Gugués hidroksil bisa mèlu ing jero ikatan hidrogen, saéngga nggawé etanol dadi cair lan luwih angèl nguap saka senyawa orèganik liyané kanthi massa molekul kang padha.
Etanol yaiku pelarut kang serbaguna, èncèr ing jero banyu lan pelarut organik liyané, kayata asam asetat, aseton, benzena, karbon tetraklorida, kloroform, dietil eter, etilena glikol, gliserol, nitrometana, piridina, lan toluena.[7][8] Etanol uga larut ing hidrokarbon alifatik kang ènthèng, kayata pentana dan heksana, lan uga larut ing senyawa klorida alifatik kayata trikloroetana lan tetrakloroetilena.[8]
Campuran etanol-banyu nduwé volume kang luwih cilik saka gunggung cairan loro kasebut kanthi kapisah. Campuran etanol lan banyu kanthi volume kang padha bakal ngasilaké campuran kang volumené mung tikel 1,92 saka gunggung volume wiwitan.[7][9] Pencampuran etanol dan air bersifat eksotermik dengan energi sekitar 777 J/mol dibebaskan pada 298 K[10].
Campuran etanol lan air bakal mbentuk azeotrop hingan watara kanthi perbandingan 89 mol% etanol lan 11 mol% banyu.[11]. Perbandhingan iki uga bisa dinyatakaké minangka 96% volume etanol lan 4% volume banyu ing tekanan normal lan T = 351 K. Komposisi azeotropik iki gumantung banget karo suhu lan tekanan. Etanol bakal ngilang ing tenperatur sangisoré 300 K.[12].

Ikatan hidrogen njalari etanol murni dadi higroskopis banget, saéngga etanol bakal nyerep banyu saka udara. Sifat gugus hidroksil kang polar njalari etanol bisa larit ing akèh senyawa ion, mliginé natrium hidroksida, kalium hidroksida, magnesium klorida, kalsium klorida, amonium klorida, amonium bromida, lan natrium bromida.[8] Natrium klorida lan kalium klorida larit sithik ing etanol.[8] Mula etanol uga nduwèni ranté karbon nonpolar, etanol uga larut ing senyawa nonpolar, kayata lenga atsiri.[13] lan akèh perasa, pewarna, lan obat.
Nambahaké sawetara persèn etanol ing banyu akal ngudhunaké tegangan permukaan banyu kanthi akeh. Campuran etanol lan banyu kang luwih saka 50% etanol asifat gampang kebakar lan gampang murub. Campuran kang kurang saka 50% etanol uga bisa murub yen larutan kasebut dipanasake dhisik.
Indeks refraksi etanol yaiku 1,36242 (ing λ=589,3 nm dan 18,35 °C).[7]
Sifat-sifat kimia
Cithakan:Detail Etanol kalebu alkohol primer, kang tegesé bilih karbon uga talènan karo gugus hidroksil paling ora nduwèni atom hidrogen loro kang katalèn karo etanol. Rekasi kimia kang dilakokaké déning etanol akèh-akèhé ing sakupengé gugus hidroksilé.
Reaksi asam-basa
Gugus hidroksil etanol nggawé molekul iki rada basa. Etanol mèh netral ing njero banyu, kanthi pH 100% etanol yaiku 7,33, berbandhing karo pH banyu murni kang gedhéné 7,00. Etanol bisa diowahi dadi konjugat basané, ion etoksida (CH3CH2O−), kanthi ngreaksiké karo logam alkali kayata natrium:
utawa karo basa kuat kaya natrium hidrida:
- CH3CH2OH + NaH → CH3CH2ONa + H2.
Reaksi kaya iki ora bisa dilakokaké ing larutan akuatik, amarga banyu luwih asam tinimbang etanol, saéngga kawentuké hidroksida luwih disenengi tinimbang kawentuké etoksida.
Cathetan suku
- ↑ Myers, Richard L.; Myers, Rusty L. (2007). The 100 most important chemical compounds: a reference guide. Westport, Conn.: Greenwood Press. kc. 122. ISBN 0313337586.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Roach, J. (18 Juli 2005) "9,000-Year-Old Beer Re-Created From Chinese Recipe." National Geographic News., diundhuh 14 November 2005.
- ↑ Couper, A.S. (1858). "On a new chemical theory." Philosophical magazine 16, 104–116. Online reprint
- ↑ Hennell, H. (1828). "On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed". Philosophical Transactions. 118 (365–71): 365. doi:10.1098/rstl.1828.0021.
- ↑ Robert Siegel (2007-02-15). "Ethanol, Once Bypassed, Now Surging Ahead". NPR. Dibukak ing 2007-09-22.
- ↑ Joseph DiPardo. "Outlook for Biomass Ethanol Production and Demand" (PDF). United States Department of Energy. Dibukak ing 2007-09-22.
- ↑ a b c CRC Handbook of Chemistry, 44th ed.
- ↑ a b c d Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (édhisi ka-9th). Rahway, N.J., U.S.A: Merck. ISBN 0-911910-26-3.
- ↑ "Ethanol". Encyclopedia of chemical technology. Vol. 9. 1991. kc. 813.
- ↑ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). "The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing". Aust J Chem. 33 (10): 2103–19. doi:10.1071/CH9802103.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Lei Z, Wang H, Zhou R, Duan Z (2002). "Influence of salt added to solvent on extractive distillation". Chem Eng J. 87: 149–56. doi:10.1016/S1385-8947(01)00211-X.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Pemberton RC, Mash CJ (1978). "Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 to 363.15 K determined by an accurate static method". J Chem Thermodyn. 10 (9): 867–88. doi:10.1016/0021-9614(78)90160-X.
{{cite journal}}: Unknown parameter|month=ignored (pitulung) - ↑ Merck Index of Chemicals and Drugs, 9th ed.; monographs 6575 through 6669


